ОТ ГЛАВНОГО РЕДАКТОРА
ОЦЕНКА ТЕХНОЛОГИЙ ЗДРАВООХРАНЕНИЯ
Менингококковая инфекция (МИ) остаётся одной из самых опасных для жизни со средним уровнем летальности до 15 %. На МИ приходится самое большее число смертей из всех инфекционных заболеваний среди детей моложе 17 лет. При этом эффективным методом профилактики заболевания является вакцинация. Цель исследования. С помощью имитационного моделирования оценить потенциальные эпидемиологические и экономические выгоды при вакцинировании детей от МИ в возрасте до 1 года в Москве четырёхвалентной вакциной против менингококка серогрупп A, C, W, Y. Методы. Проведена оценка потенциальных показателей заболеваемости и смертности детей в возрасте до 1 года после вакцинации условной когорты с учётом периода сохранения устойчивого поствакцинального иммунитета. Полученные данные сопоставлены с показателями заболеваемости МИ в Москве. Произведён расчёт монетарных эквивалентов экономических выгод с учётом стоимости вакцинирования, прямых и непрямых расходов. Результаты. После вакцинации в горизонте 5 лет сохранения напряжённости иммунитета возможно снижение числа случаев заболевания на 73.0 %, смертности — в среднем на 85 %. Вакцинирование детей до года может снизить число случаев инвалидности, возникающих после тяжелых форм инфекции. В итоге экономический ущерб от МИ может быть снижен на 75 %. Заключение. Учитывая, что в Москве наблюдается один из самых высоких уровней заболеваемости МИ, эпидемиологические выгоды от вакцинации детей до 1 года могут быть значительными. При этом экономические выгоды в перспективе могут значительно превысить затраты на вакцинацию. Представляется целесообразным ускорить внедрение вакцинации детских контингентов против МИ.
ДОКАЗАТЕЛЬНАЯ МЕДИЦИНА
Обзор посвящён обсуждению новых направлений в доказательной медицине, переосмыслению доказательной базы в медицине с упором на демонстрацию эффективности и безопасности новых терапевтических средств и медицинских технологий, от редактирования генов до алгоритмов искусственного интеллекта. В то же время клинические исследования лекарственных средств (ЛС) тоже не стоят на месте, происходит активное развитие, появляются новые подходы, методы и дизайны. Процесс разработки, регистрации и выхода на рынок любого ЛС занимает значительный период времени, требует высоких финансовых затрат и человеческих ресурсов. Золотым стандартом доказательной медицины исходно считали рандомизированные контролируемые исследования, в то же время для них присущи объективные недостатки: ограниченность выборки, неспособность контролировать все факторы; недостаточное время наблюдения, негативное воздействие на участников, невозможность определить причинно-следственные связи; ограниченность методов измерения, ограниченный бюджет и др. В данном обзоре рассматриваются направления развития методологии клинических исследований. Активное внедрение новых дизайнов, таких как Адаптивные клинические испытания, «Мастер» протоколы, включающие Зонтичное исследование, Корзинное исследование, Исследования платформы, Мастер-обсервационные испытания и расширение использования Испытаний на одном пациенте (N-of-1 trial), позволяет сделать исследования более эффективными, релевантными и применимыми к реальным условиям практики здравоохранения и пациентоориентированными. В обзоре мы также рассматриваем как положительные, так и отрицательные стороны расширенного применения биомаркеров и Цифровых конечных точек в клинических исследованиях и виртуальных клинических испытаний, в которых используют математические модели для изучения гетерогенности пациентов и её влияния на решение различных терапевтических вопросов. Процесс экспертизы и регуляторного одобрения по-прежнему замедляет выход ЛС на фармацевтический рынок. В обзоре рассматриваются изменения в подходах регуляторов (FDA, EMEA и Минздрав России) к процедуре регистрации ЛС. Пандемия COVID-19 и санкции привели к необходимости расширения списка ЛС с разрешённой ускоренной регистрацией. Однако ускоренная регистрация вызывает много вопросов, касающихся достаточности уровня доказательности и безопасности. Как мы видим, необходим глубокий синтез и объединение всех имеющихся данных для достижения доказательной медицины следующего поколения. Основная задача в ближайшие два десятилетия будет заключаться в том, чтобы использовать потенциал многомерной генерации доказательств путём извлечения, сопоставления и получения больших массивов данных естественного течения заболеваний, геномики и всех других анализов омики, всех опубликованных клинических исследований, RWD для предоставления доказательств следующего поколения.
ИССЛЕДОВАНИЯ РЕАЛЬНОЙ КЛИНИЧЕСКОЙ ПРАКТИКИ
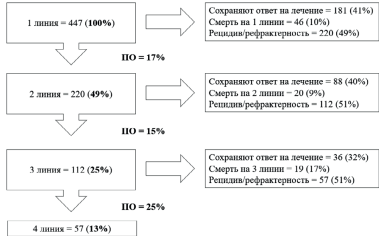
Актуальность. Несмотря на значительное улучшение терапевтических возможностей, у больных множественной миеломой (ММ) сохраняется волнообразное течение заболевания с периодами ремиссий и рецидивов, что требует назначение новых линий терапии. Методы. Мы проанализировали виды и результаты лечения, показатели отсева (ПО) — доля выбывших из программной терапии, а также рефрактерность к терапии на разных линиях у 447 пациентов с ММ в период с 2010 по 2022 гг. Результаты. Частота ПО составила 17% между 1-й и 2-й, 15% между 2-й и 3-й и 25% между 3-й и 4-й линиями терапии. Согласно многофакторному регрессионному анализу единственным значимым предиктором, увеличивающим риск отсева пациента по причине прогрессии или смерти, был высокий риск ММ. Частота рефрактерности к бортезомибу, леналидомиду или даратумумабу увеличивается с каждой новой прогрессией ММ. Доля пациентов с двойной рефрактерностью после 1-й, 2-й и 3-й линий терапии составила 6%, 26% и 53% соответственно, с тройной рефрактерностью после 3-й линии терапии — 54%. Наличие рефрактерности к бортезомибу или леналидомиду снижало шансы достижения очень хорошего частичного ответа или выше (ОХЧР+) в 2,6 раза. В целом частота общего ответа и ОХЧР+ уменьшалась с каждой новой линией терапии с 74% и 53% на 1-й линии до 25% и 15% на 4-й линии терапии. Медиана общей выживаемости (ОВ) во всей популяции равнялась 7,6 лет, ожидаемая 5-летняя ОВ — 67%, 10-летняя ОВ — 44%. Медиана выживаемости без прогрессии (ВБП) составила 20 мес. на 1-й линии терапии, 19 мес. на 2-й и 7 мес. на 3-й линии, а ожидаемая 5-летняя ВБП — 25%, 18% и 10% соответственно. Выводы: в связи с этим мы наблюдаем сохраняющуюся тенденцию в использовании цисплатин-содержащих схем химиотерапии «спасения», особенно у пациентов с агрессивным течением, включая экстрамедуллярные формы ММ. Эти пациенты могли бы стать кандидатами для терапии биспецифическими антителами и CAR T-клеточной терапии, но в России эти опции пока не доступны.
Хроническая обструктивная болезнь лёгких (ХОБЛ) часто сочетается с атеросклеротическими сердечно-сосудистыми заболеваниями (АССЗ), среди которых важное место занимает облитерирующий атеросклероз артерий нижних конечностей (ОААНК). Целью исследования была оценка клинико-функциональных и иммунологических характеристик ХОБЛ с фенотипом частых обострений в сочетании с ОААНК. Материалы и методы. В исследование были включены 4 группы пациентов с ХОБЛ: 20 пациентов с ХОБЛ с редкими обострениями без АССЗ, 20 пациентов с ХОБЛ с частыми обострениями без АССЗ, 20 пациентов с редкими обострениями и ОААНК и 20 пациентов с ХОБЛ с фенотипом частых обострений и ОААНК. В качестве сравнения оценивались данные у 20 здоровых лиц из группы контроля. Оценивались клинические данные и данные спирометрии. Проведён анализ общеклинических лабораторных данных, а также иммунологических маркеров (интерлейкин-1 бета (IL-1β) и фактор некроза опухоли (TNF) в конденсате выдыхаемого воздуха (КВВ) и сыворотке крови. Результаты: были установлены более высокие значения IL-1β и TNF в КВВ и сыворотке крови у пациентов с ХОБЛ и ОААНК по сравнению с пациентами с ХОБЛ без АССЗ (p<0,05) и здоровыми лицами группы контроля (p<0,001). Высокая частота обострений ХОБЛ усиливает клинико-иммунологические характеристики тяжести заболевания как без АССЗ, так и при сопутствующем ОААНК. Выводы. ХОБЛ с фенотипом частых обострений и ОААНК характеризуется большей выраженностью локального и системного воспаления, чему соответствует повышение маркеров воспаления в КВВ и сыворотке крови.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Глаукома — заболевание, связанное с повышением внутриглазного давления (ВГД). Из фармакологических средств для лечения глаукомы различают препараты первой (наиболее эффективны и безопасны) и второй линии лечения. К первой линии лечения относятся аналоги простагландинов и бета-адреноблокаторы. Используемые в настоящее время аналоги простагландинов (латанопрост, биматопрост, тафлупрост и травопрост) являются аналогами PG F2α, осуществляющие своё действие через стимуляцию рецепторов FP. Их отличает оптимальное соотношение эффективности и риска побочного действия. Они удобны для пациента, т. к. для лечебного действия достаточно назначения 1 раз в день. Вследствие этого лечение глаукомы рационально начинать с одного из препаратов данной группы. С точки зрения фармакоэкономики наиболее доступным препаратом простагландинов является латанопрост, который в целом столь же эффективен, как и другие аналоги простагландинов. β-адреноблокаторы снижают продукцию ВГЖ, образование которой контролируется β1- и β2-адренорецепторами. Поэтому неселективные β-блокаторы (тимолол, левобунолол, метипранолол и картеолол) имеют фармакодинамическое преимущество перед селективными антагонистами β1-адренорецепторов (бетаксолол). Проведённые клинические исследования β-блокаторов показали, что, учитывая стоимость, эффективность и безопасность, тимолол оказался наиболее предпочтителен в терапии глаукомы. При наличии медицинских противопоказаний к применению препаратов первой линии или для усиления их эффективности используются α2-адреномиметики (апраклонидин и бримонидин), ингибиторы карбоангидразы (как правило, местного действия: дорзоламид и бринзоламид), М-холиномиметики (пилокарпин, карбахол и эхотиофат), а также ингибиторы Rho-киназы (рипасудил)
Актуальность. Полипрагмазия в приёме лекарственных средств как одно из основных следствий коморбидной патологии является хорошо известным фактором риска неблагоприятных побочных реакций (НПР). НПР часто выступают причиной утяжеления течения заболеваний, инвалидизации и смертности, особенно у пожилых людей. Эта тенденция диктует необходимость оптимизации применяемой фармакотерапии пожилых пациентов с помощью аналитических алгоритмов оценки безопасности. Цель. Анализ безопасности применяемой антибактериальной и бронхолитической фармакотерапии у пациентов ХОБЛ старше 65 лет с помощью сравнительного анализа полученных данных по методикам системы EURO FORTA и критериев STOPP/START. Методы. Для проведения исследования на основании данных стационарных карт был составлен портрет пациента с определением индексов Charlson и ADO. Определение влияния тяжести течения ХОБЛ и коморбидной патологии на полипрагмазию осуществлялось с использованием коэффициента корреляции Спирмена (r). Оценка эффективности в применении аналитических критериев EURO FORTA и STOPP/START была проведена методом сравнительного анализа. Статистическая обработка полученных данных выполнялась с помощью программы StatPlus 7.0. Результаты. Были исследованы 113 стационарных карт пожилых пациентов среднетяжёлого и тяжёлого течения ХОБЛ. На фоне высокой выраженности коморбидной патологии у 102 пациентов (90,2%) наблюдалась полипрагмазия. Применение аналитических инструментов EURO FORTA и STOPP/START в анализе бронхолитической и антибактериальной терапии, позволили выявить 71 назначение потенциально не рекомендованных препаратов у 61 (53,9%) пациента. Заключение. Анализ показал высокий уровень назначения препаратов, обладающих существенным риском в применении у пожилых пациентов. Проведённый сравнительный анализ двух аналитических инструментов оценки применяемой фармакотерапии EURO FORTA и STOPP/START продемонстрировал необходимость их совместного использования для достижения наиболее высоких результатов в обеспечении безопасности лечения пожилых пациентов, так как они успешно дополняют друг друга.
ЭПИДЕМИОЛОГИЯ
Актуальность. Высокая распространённость хронического лимфолейкоза (ХЛЛ) у пациентов европейской популяции в пожилом и старческом возрасте диктует необходимость поиска общедоступного решения вопроса прогноза в этой когорте пациентов. Ранее была установлена связь выживаемости больных ХЛЛ со значением скорости клубочковой фильтрации (СКФ) на момент постановки диагноза. Цель исследования: оценить связь СКФ с выживаемостью пациентов ХЛЛ в динамике заболевания. Материалы и методы: исследовано 207 пациентов (98 мужчин и 109 женщин) в возрасте от 45 до 80 лет с ХЛЛ A-C по Binet и известной общей выживаемостью. Ежегодно с 1 по 5 год течения заболевания учитывали максимальное значение СКФ пациента по формуле CKD-EPI. Данные обрабатывались методом интеллектуального анализа данных с использованием логического алгоритма классификации. Результаты. При значении СКФ более 76 мл/ мин/1,73 м2 в течение первого года заболевания, более 75 мл/мин/1,73 м2 в течение второго года заболевания, более 70 мл/мин/1,73 м2 в течение третьего года заболевания, более 68 мл/мин/1,73 м2 в течение четвёртого и пятого годов заболевания пациент преодолеет расчётные параметры медианы выживаемости для соответствующей стадии ХЛЛ по Binet. В противном случае — общая выживаемость пациента будет меньше расчётной медианы выживаемости по Binet. В статье приведены показательные клинические примеры. Заключение. Получено, что значение СКФ у пациентов ХЛЛ планомерно снижается с течением заболевания, однако значение этого параметра в динамике заболевания можно рассматривать в качестве значимого фактора прогноза выживаемости пациентов с ХЛЛ. По результатам оформлена заявка на изобретение № 2023108368.
ISSN 2618-8473 (Online)