Перейти к:
Микробиологический мониторинг многопрофильной медицинской организации: основа стратегического планирования в рамках реализации эпидемиологической безопасности
https://doi.org/10.37489/2588-0519-2023-4-86-95
Аннотация
Актуальность. Мониторинг антибиотикорезистентности и частоты выделения микроорганизмов на региональном уровне в каждой медицинской организации имеет первостепенное значение для реализации эпидемиологической безопасности. Цель. Выявить основные микробиологические тенденции на основе анализа микрофлоры пациентов многопрофильного стационара для реализации слабых сторон в мероприятиях стратегического планирования. Материалы и методы. Комплексный анализ фармакоэпидемиологических результатов потребления антимикробных препаратов с расчётными индексами лекарственной устойчивости и данными микробиологического мониторинга продемонстрировал наличие слабых и сильных сторон для стратегического развития многопрофильного стационара на регионарном уровне в части эпидемиологической безопасности. Результаты. Статистически значимые различия микробиологической структуры возбудителей предопределяются профильностью оказания медицинской помощи. Основной тенденцией изменения микрофлоры многопрофильного стационара в целом является превалирование грибковых и грамотрицательных возбудителей над грамположительным. Наличие относительного высокого индекса потребления цефалоспоринов 3–4 поколений, фторхинолонов, карбапенемов, защищённых пенициллинов предопределяет высокий индекс лекарственной устойчивости Klebsiella pneumoniae (0,86) и характеризует основные микробиологические тенденции многопрофильной клиники. Заключение. Стратификация риска по уровню полирезистентных возбудителей, применение сдерживающих стратегий назначения антимикробных препаратов, реализация образовательных модулей, оценка эффективности и мониторинг программы стратификации риска в рамках антимикробных технологий, анализ данных микробного пейзажа с применением программ поддержки для принятия решений — основные задачи функционирования мультидисциплинарной команды специалистов в многопрофильной клинике для сдерживания антибиотикорезистентности.
Ключевые слова
Для цитирования:
Боброва О.П., Фетисов А.О., Зырянов С.К. Микробиологический мониторинг многопрофильной медицинской организации: основа стратегического планирования в рамках реализации эпидемиологической безопасности. Качественная клиническая практика. 2023;(4):86-95. https://doi.org/10.37489/2588-0519-2023-4-86-95
For citation:
Bobrova O.P., Fetisov A.O., Zyryanov S.K. Microbiological monitoring of a multidisciplinary medical organization: the basis of strategic planning in the framework of the implementation of epidemiological safety. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2023;(4):86-95. (In Russ.) https://doi.org/10.37489/2588-0519-2023-4-86-95
Введение / Introduction
Проблема бактериальных инфекций у пациентов стационарного профиля является актуальной проблемой современной системы здравоохранения [1][2]. Возможность колонизации микроорганизмами группы ESСAPE в стационарных условиях у пациентов предопределяет риск трансформации в инфекцию, связанную с оказанием медицинской помощи, за счёт нарушения иммунитета, инвазивных вмешательств, нарушения нутритивного статуса, высокого индекса коморбидности, возможности cross-контаминации, а также существующих механизмов инвазии через эпителиальные барьеры, возможности трансформации метаболической активности микроорганизмов в персистирующий режим (микробы-персистеры) [3][4]. Интеграция принципов безопасного оказания медицинской помощи пациентам в современную динамично развивающуюся систему здравоохранения является первостепенной задачей реализации риск-ориентированного подхода, в том числе и в части эпидемиологической безопасности [5][6]. Мониторинг антибиотикорезистентности и частоты выделения микроорганизмов с ассоциированной устойчивостью ко многим антибактериальным препаратам на региональном уровне в каждой медицинской организации имеет первостепенное значение с клинической точки зрения для реализации стратегических и тактических мероприятий, направленных на сдерживание распространения антибиотикорезистентности [7][8].
Цель / Aim
Выявить основные микробиологические тенденции на основе анализа микрофлоры пациентов моногопрофильного стационара для реализации слабых сторон в мероприятиях стратегического планирования.
Материалы и методы / Materials and methods
Проведён анализ результатов мониторинга структуры выделенных 1 850 патогенов от 571 пациентов и уровня резистентности на базе многопрофильного стационара плановой специализированной медицинской помощи (ФГБУ ФСНКЦ ФМБА России, Красноярск) по терапевтическому (кардиологическому + неврологическому + реабилитационному), хирургическому, реанимационному и COVID-профилям. Применение антибактериальных препаратов в ФГБУ ФСНКЦ ФМБА рассчитывалось с использованием методики АТС/DDD анализа, рекомендованного ВОЗ [4]. Расчётными методами на основании условных суточных доз (DDD) [5] ВОЗ для каждого антибактериального препарата определялось потребление антибиотиков (DID) в целом по учреждению и по профилю, разделяя общее количество DDD применяемых антибиотиков (DDDs) за 100 койко-дней на общий койко-день ((DDDs*100)/общий койко-день) [5]. Общее потребление антимикробных препаратов всех изучаемых классов антимикробных препаратов рассчитывалось суммированием DDDs/100 к.д. каждого отдельно взятого антибиотика. Частота потребления (DID) каждого антибактериального препарата или группы антибиотиков рассчитывалась отношением потребления каждого класса антибактериальных препаратов к общему потреблению в исследуемый период времени. По каждому выделенному патогену анализировалась частота резистентности. Определение антибиотикорезистентности проводилось с учётом данных фармакоэпидемиологического анализа, перемножая частоту резистентности патогенов на частоту потребления данного класса антибактериального препарата. Индекс лекарственной устойчивости (ИЛУ) у каждого патогена определялся суммированием показателей антибиотикорезистентности всех изучаемых классов антибактериальных препаратов в исследуемый период. Значение индекса лекарственной устойчивости «ноль» интерпретировалось как отсутствие резистентности, «один» — как полное отсутствие чувствительности к изучаемым антибактериальным препаратам. Количественные показатели потребления антибактериальных препаратов рассчитывались ежеквартально в целом по ФСНКЦ ФМБА. Суммарные показатели частоты резистентности также определялись ежеквартально.
Статистический анализ: применяли стандартные методы описательной статистики с учётом нормальности распределения по критерию Колмогорова-Смирнова. Для сопоставления двух выборок по частоте признака и определения уровня значимости различия процентных долей использовали критерий χ². Для оценки статистической значимости в двух выборках применяли t-критерий Стьюдента для параметрических данных и критерий Вилкоксона для непараметрических. Различия считались достоверными при уровне значимости р<0,05
Результаты / Results
Всего за шесть месяцев 2023 г. ретроспективно проанализировано 1 850 этиологически значимых микроорганизмов, выделенных у 571 пациента с определением лидирующих: Klebsiella spp.; Escherichia coli; Candida spp.; Staphylococcus spp. (табл. 1).
Таблица 1
Динамика структуры выделенных патогенов по стационару
в первом полугодии 2023 г.
Table 1
Dynamics of the structure of isolated pathogensby hospital
in the first half of 2023
Микроорганизмы | 1 кв. 2023 абс. (%) | 2 кв. 2023 абс. (%) | р |
Acinetobacter spp. | 14 (2,2) | 36 (3%) | 0,313 |
Candida spp. | 98 (15,3%) | 169 (14%) | 0,459 |
Enterobacter spp. | 6 (0,9%) | 25 (2,1%) | 0,071 |
Enterococcus spp. | 71 (11,1%) | 62 (5,1%) | <0,001 |
Escherichia coli | 97 (15,1%) | 248 (20,6%) | 0,005 |
Klebsiella spp. | 116 (18,1%) | 330 (51,5%) | <0,001 |
Proteus spp. | 33 (5,1%) | 93 (7,7%) | 0,038 |
Pseudomonas aeruginosa | 12 (1,9%) | 79 (6,6%) | <0,001 |
Staphylococcus spp. | 104 (16,2%) | 109 (9%) | <0,001 |
Другие грам+ патогены | 10 (1,6%) | 19 (1,6%) | 0,980 |
Другие грам- патогены | 80 (12,5%) | 39 (3,2%) | <0,001 |
Итого | 641 | 1 209 |
Также в динамике отмечалось статистически значимое увеличение количества Proteus spp., Pseudomonas aeruginosa, уменьшение Enterococcus spp. во 2-м квартале в сравнении с 1-м кварталом 2023 года (см. табл. 1).
Частота определения ассоциативных сообществ микроорганизмов в 1-м квартале составляла 30%, во 2-м квартале — 47% с преобладанием трёхкомпонентных ассоциаций при микробиологическом исследовании мокроты и двухкомпонентных — при исследовании мочи.
Структура распределения биоматериала демонстрирует преобладание мокроты, мочи и крови на протяжении 1-го полугодия 2023 года (рис. 1).

Рис. 1. Структура биоматериала в первом полугодии 2023 г. в целом по стационару
Fig. 1. The structure of the biomaterial in the first half of 2023 in general for the hospital
Динамика изменения структуры патогенов с дифференциацией на грамположительные и грамотрицательные микроорганизмы демонстрирует лидирование грамотрицательных и грибковых патогенов в течение первого полугодия 2023 г. по стационару, что характеризует особенности микробного пейзажа в ФГБУ ФСНКЦ ФМБА в целом и демонстрирует наличие значимых различий в 1-м и 2-м кварталах 2023 г. для Enterococcus spp., Escherichia coli, Klebsiella spp., Pseudomonas aeruginosa, Proteus spp., Staphylococcus spp. (см. табл. 1). Статистически значимое уменьшение количества грамположительных (Enterococcus spp., Staphylococcus spp.) и нарастание грамотрицательных (Escherichia coli, Klebsiella spp., Proteus spp., Pseudomonas aeruginosa) демонстрирует основную тенденцию изменения микрофлоры многопрофильного стационара в целом.
Более детальный анализ грибковых патогенов продемонстрировал статистически значимое увеличение за 1–2 кварталы 2023 г. Candida albicans spp. в сравнении с Candida non-albicans spp. (табл. 2).
Таблица 2
Динамика структуры грибковых патогенов по стационару
в первом полугодии 2023 г.
Table 2
Dynamics of the structure of fungal pathogens in the hospital
in the first half of 2023
1-й квартал | 2-й квартал | р | |
Candida albicans | 93 | 105 | 0,007 |
Candida glabrata | 11 | 11 | 1,000 |
Candida guilliermondii | 0 | 1 | 0,393 |
Candida kefyr | 7 | 6 | 0,380 |
Candida krusei | 2 | 8 | 0,149 |
Candida lusitaniae | 4 | 1 | 0,084 |
Candida parapsilosis | 2 | 1 | 0,387 |
Candida tropicalis | 12 | 21 | 0,476 |
Candida nonalbicans spp. | 38 | 49 | 0,718 |
Проведённый анализ продукции механизмов резистентности продемонстрировал статистически значимое сокращение выработки ESBL у Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis; KPC — у Klebsiella pneumoniae соответственно и отсутствие статистически значимого увеличения частоты выделения комбинаций маркеров резистентности (ESBL; KPC) в динамике у Escherichia coli и Klebsiella pneumoniae, что характеризует определённые тенденции в формировании антибиотикорезистентности (рис. 2).

Рис. 2. Динамика частоты маркеров резистентности у выделенных микроорганизмов
в первом полугодии 2023 г. по стационару
Fig. 2. Dynamics of the frequency of resistance markers in isolated microorganisms
in the first half of 2023 in the hospital
Примечания: ESBL — бета-лактамазы расширенного спектра действия;
KPC — сериновые бета-лактамазы класса А.
Notes: ESBL — extended spectrum beta-lactamase;
KPC — serine beta-lactamase class A.
Детальный анализ частоты продуцирования маркеров резистентности БЛРС продемонстрировал статистически незначимое (р≥0,05) лидирование E. coli во всех представленных профилях. Статистически значимое (р=0,006) уменьшение частоты реализации БЛРС характерно только для E. coli в хирургическом профиле во 2-м квартале 2023 г. в сравнении с первым (рис. 3).
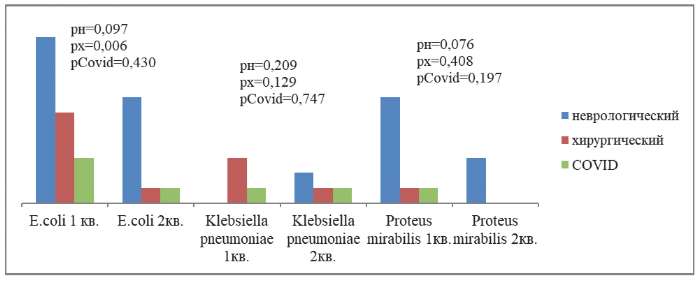
Рис. 3. Динамика частоты продуцирования БЛРС
у грамотрицательных микроорганизмов в целом по стационару
в первом полугодии 2023 г.
Fig. 3. Dynamics of the frequency of ESBL production
in gram — negative microorganisms in the hospital as a whole
in the first half of 2023
Примечания: р — уровень значимости: рн — неврологический профиль;
рх — хирургический профиль; рCovid — Covid-госпиталь.
Notes: p — level of significance: pн — neurological profile;
px — surgical profile; pCovid — Covid-hospital.
Частота продуцирования карбапенемаз наиболее значимо представлена у Klebsiella pneumoniae, выделяемой от пациентов с Covid-ассоциированной инфекцией со статистически значимым снижением во 2-м квартале у пациентов неврологического профиля (р=0,003) и Covid профиля (р≤0,001) (рис. 4).

Рис. 4. Динамика частоты продуцирования карбапенемаз
у грамотрицательных микроорганизмов в целом по стационару
в первом полугодии 2023 г.
Fig. 4. Dynamics of the frequency of production of carbapenemase
in gram-negative microorganisms in general in the hospital
in the first half of 2023
Наибольшая частота продуцирования MRS (MRSA, MRSE) наиболее представлена у пациентов неврологического профиля и с Covid-ассоциированной инфекцией (р≥0,05) со статистически значимым снижением продукции метициллин резистентности (р≤0,001) во 2-м квартале у пациентов с Covid-ассоциированной инфекцией (рис. 5).
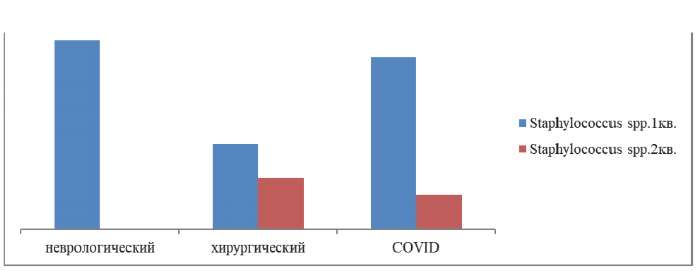
Рис. 5. Динамика частоты продуцирования метициллинрезистентности
у грамположительных микроорганизмов по стационарным профилям
в первом полугодии 2023 г.
Fig. 5. Dynamics of the frequency of production of methicillin resistance
in gram — positive microorganisms according to stationary profiles
in the first half of 2023
Среди структурных подразделений, участвующих в микробиологических исследованиях, значимо лидирует отделение для лечения COVID-инфицированных пациентов, отделения медицинской реабилитации №1 и №3 (табл. 3) за счёт профильности пациентов.
Таблица 3
Количественные показатели выделенных микроорганизмов
в разрезе структурных подразделений
Table 3
Quantitative indicators of isolated microorganisms
in the context of structural divisions
1-й квартал | 2-й квартал | р | |
Отделение медицинской реабилитации №1 | 23 | 67 | 0,062 |
Отделение медицинской реабилитации №2 | 88 | 179 | 0,517 |
Отделение медицинской реабилитации №3 | 49 | 216 | <0,001 |
COVID отделение | 301 | 507 | 0,048 |
Приемное отделение №2 | 58 | 65 | 0,003 |
Хирургическое отделение | 93 | 90 | <0,001 |
Терапевтическое отделение | 8 | 45 | 0,003 |
Отделение анестезиологии и реанимации | 19 | 24 | 0,187 |
Другие | 2 | 16 | 0,013 |
Итого | 641 | 1209 |
Значимый рост (р≤0,05) количественных показателей по абсолютным значениям выделенных микроорганизмов отмечен для отделения медицинской реабилитации №3; терапевтического, хирургического, приёмного №2 отделений; COVID-отделения. Объём потребления антибактериальных препаратов за первое полугодие 2023 года демонстрирует лидирование фторхинолонов, цефалоспоринов 3-го поколения, антимикотиков (флуконазол), что объясняется проводимой периоперационной антибиотикопрофилактикой и терапией инфекций, а также демонстрирует соответствие структуре выделенных патогенов.

Рис. 6. Структура потребления антибактериальных препаратов
в многопрофильном стационаре за 1-е полугодие 2023 г.
Fig. 6. The structure of consumption of antibacterial drugs
in a multidisciplinary hospital for the 1st half of 2023
Анализ динамики частоты резистентности грамотрицательных патогенов в разрезе классов антимикробных препаратов продемонстрировал статистически значимое нарастание у E. coli к защищённым пенициллинам, карбапенемам, фторхинолонам, цефалоспоринам 3–4 поколения. Для Klebsiella pneumoniae сохраняется чувствительность к амикацину при нарастающей резистентности к ЦС 3–4 поколений, сохраняется высокий уровень резистентности в 1–2 кварталах 2023 г. к карбапенемам, фторхинолонам, защищённым аминопенициллинам. У Proteus mirabilis характерно нарастание резистентности со статистической значимостью (р≤0,05) к защищённым пенициллинам и карбапенемам, продемонстрирован высокий уровень резистентности к фторхинолонам, цефалоспоринам 3–4 поколения. Резистентные штаммы к карбапенемам, фторхинолонам продемонстрировали в динамике нарастание резистентности у Pseudomonas aeruginosae к ЦС 3–4 поколения, амикацину (табл. 4).
Таблица 4
Частота резистентности грамотрицательных патогенов
в разрезе антибактериальных препаратов
Table 4
The frequency of resistance of gram-negative pathogens
in the context of antibacterial drugs
Группы антимикробных препаратов | E. coli | Klebsiella pneumoniae | Proteus mirabilis | Pseudomonas aeruginosae | ||||
R1 | R2 | R1 | R2 | R1 | R2 | R1 | R2 | |
Амикацин | 0,09 | 0,18 | 0,56 | 0,3 | 0,29 | 0,42 | 0,5 | 0,68 |
Уровень значимости, р | 0,063 | ≤0,001 | 0,055 | 0,010 | ||||
Защищённые пенициллины | 0,51 | 0,76 | 0,86 | 0,9 | 0,32 | 0,58 | ||
Уровень значимости, р | ≤0,001 | 0,385 | ≤0,001 | |||||
Карбапенемы | 0,06 | 0,14 | 0,8 | 0,75 | 0,71 | 0,55 | 0,82 | 0,9 |
Уровень значимости, р | 0,06 | 0,554 | 0,020 | 0,104 | ||||
Фторхинолоны | 0,5 | 0,87 | 0,85 | 0,87 | 0,68 | 0,74 | 0,84 | 0,87 |
Уровень значимости, р | ≤0,001 | 0,684 | 0,350 | 0,547 | ||||
Цефалоспорины 3–4 поколения | 0,65 | 0,8 | 0,9 | 0,8 | 0,57 | 0,61 | 0,25 | 0,95 |
Уровень значимости, р | 0,018 | 0,048 | 0,566 | ≤0,001 | ||||
Примечания: R1 — уровень резистентности в 1 квартал;
R2 — уровень резистентности в 2 квартал.
Notes: R1 — resistance level in 1 quarter;
R2 — the level of resistance in the 2nd quarter.
Расчёт частоты потребления антимикробных препаратов ((потребление DDDs/100кд)/ (общее потребление АМП DDDs / 100кд)) продемонстрировал межквартальное нарастание частоты потребления для амикацина, цефалоспоринов 3–4 поколения, фторхинолонов и триметоприма/сульфаметаксазола (за счёт ВИЧ-инфицированных пациентов с Covid-ассоциированной инфекцией (рис. 7).

Рис. 7. Динамика частоты потребления антимикробных препаратов в целом по стационару
за 1–2 кварталы 2023 г.
Fig. 7. Dynamics of the frequency of consumption of antimicrobial drugs in general in the hospital
for 1–2 quarters of 2023

Рис. 8. Динамика индекса лекарственной устойчивости по стационару
за 1–2 кварталы 2023 г. в разрезе грамотрицательных микроорганизмов
Fig. 8. Dynamics of the drug resistance index for the hospital
for the 1–2 quarters of 2023 in the context of gram — negative microorganisms
Нарастание ИЛУ для Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis является статистически не значимым, что может удовлетворительно характеризовать тенденции микробиологического пейзажа и относительно низкой потребляемостью антимикробных препаратов за счёт планового характера многопрофильной клиники, соблюдения сроков и обоснованностью выбора периоперационной антибиотикопрофилактики у пациентов хирургического профиля.
Обсуждение результатов / Discussion
Нарастание и превалирование в структуре возбудителей инфекционного процесса грамотрицательных возбудителей со статистической значимостью Escherichia coli (р=0,005), Klebsiella spp. (р<0,001), Proteus spp. (р=0,038 ), Pseudomonas aeruginosa (р<0,001) и сокращение выделения Enterococcus spp. (р<0,001) характеризует особенности стационарной микрофлоры группы ESCAPE (Enterococcus faecium, Staphylococcus aureus MRSА, Klebsiella pneumoniae, Pseudomonas aeruginosa и Enterobacteriaceae) в постковидном периоде в ФСНКЦ ФМБА. Выявленная лидирующая структура возбудителей соответствует основным общемировым тенденциям изменения микрофлоры в постковидном периоде [10–12].
Превалирование грибковых возбудителей наряду с бактериальными в первом полугодии 2023 г. объясняется за счёт госпитализации пациентов с клиническими и лабораторными маркерами вторичной иммунной недостаточности (пациенты с хроническим алкоголизмом и ВИЧ-инфицированные на фоне Covid-ассоциированной инфекции; пациенты отделения медицинской реабилитации с осложненными формами цереброваскулярной патологии и имеющие факторы риска грибковых возбудителей — предлечённость антимикробными препаратами, предшествующие госпитализации, инвазивные процедуры, коморбидность и др.) [13][14]. Лидирующий характер грибов Candida albicans spp. в структуре грибковых патогенов предопределяет удовлетворительный уровень безопасности и возможность применения триазолов (флуконазол) в стационарных условиях в профилактическом и лечебном режимах. Низкая доля Candida non-albicans spp. в первом полугодии 2023 года позволяет резервировать в класс резервных антимикотиков эхинокандины.
Детекция БЛРС и карбапенемаз в первом полугодии 2023 г. у выделяемых грамотрицательных микроорганизмов демонстрирует лидирование БЛРС у E. coli (46,5%), у Klebsiellaе pneumoniae (87,5%), у Proteus mirabilis (50%); карбапенемаз — у Klebsiellaе pneumoniae (66,5%). Процент реализации БЛРС и карбапенемаз у Escherichia coli, Klebsiellaе pneumoniae, Proteus mirabilis предопределяет высокую резистентность к карбапенемам, фторхинолонам, защищённым аминопенициллинам, цефалоспоринам 3–4-м поколений, что подтверждается превалированием штаммов MDR (54%) — Proteus mirabilis, XDR (72%) — Escherichia coli, PDR (92,3%) — Klebsiellaе pneumoniae. Детальный анализ реализации маркеров резистентности у грамотрицательных микроорганизмов продемонстрировал лидирование Klebsiellaе pneumoniae PDR в COVID-профиле.
Сохранение чувствительности к амикацину у Klebsiellaе pneumoniae наряду с нарастающей резистентностью к цефалоспоринам 3–4 поколения, фторхинолонам, карбапенемам предопределяет комбинированные режимы антимикробной терапии амикацина с исключением защищённых пенициллинов и обязательным включением ингибиторов бета-лактамаз с цефалоспоринами 3–4 поколений, применением полимиксинов, режимов продленной инфузии за счёт фенотипа PDR [13][15][16]. Выделенные штаммы PDR Pseudomonas aeruginosa требуют применения комбинированных антимикробных препаратов (цефтазидим/авибактам, цефтолозан/тазобактам, полимиксин В, колистиметат натрия в сочетании с амикацином, фосфомицином). Выделенные штаммы XDR /PDR E. coli и Proteus mirabilis требуют применения карбапенемов (при сохранении чувствительности) в сочетании с азтреонамом, полимиксином В, колистиметатом натрия, амикацином, фосфомицином [17–19].
Высокие частотные показатели продукции механизмов резистентности у грамотрицательных возбудителей предопределяют облигатное применение в стационарных условиях антимикробных препаратов с ингибиторами бета-лактамаз, комбинированных режимов антимикробной терапии, выбора и коррекции антимикробной терапии согласно результатам микробиологического исследования, применения сдерживающей стратегии назначения антимикробных препаратов, а также методики высокодозной продленной инфузии с обязательным включением в программы комбинированного лечения полимиксинов. Частота продуцирования MR у грамположительных микроорганизмов не превышала 19,4%, ванкомицин/линезолид резистентных штаммов стафилококков и энтерококков выделено не было за первое полугодие 2023 г., что предопределяет широкое применение в стационарных условиях гликопептидных антибактериальных препаратов (ванкомицин) взамен оксазолиденонов (линезолид). Лидирование по количественным показателям выделенных микроорганизмов Covid госпиталя, отделения медицинской реабилитации №2 и №3, хирургического отделения, приёмного отделения №2 отражает структурные тенденции изменения микробного пейзажа согласно профильности отделений и диктует необходимость ужесточения мероприятий санитарно-эпидемиологического режима, стратификационных режимов оценки факторов риска антибиотикорезистентности для выбора программ антимикробной терапии.
Относительно высокие значения индекса потребления фторхинолонов, ЦС3п, антимикотиков, аминопенициллинов объясняются значимым вкладом пациентов Covid-госпиталя. Итоговый анализ частоты резистентности грамотрицательных микроорганизмов продемонстрировал высокий уровень резистентности к защищённым пенициллинам у E. coli и Klebsiellaе pneumoniae, к карбапенемам — у Pseudomonas aeruginosa, Klebsiellaе pneumoniae, фторхинолонов — E. coli и Klebsiellaе pneumoniae, Pseudomonas aeruginosa, Proteus mirabilis; к цефалоспоринам 3–4 поколения — у E. coli и Klebsiellaе pneumoniae, Pseudomonas aeruginosa, что значимо сокращает возможность выбора антимикробных препаратов и предопределяет применение высокодозных режимов стартовой комбинированной терапии с применением ингибиторов продуцируемых механизмов резистентности, режимов продлённой инфузии, а также использование препаратов резервного ряда (полимиксины) с обязательной стратификацией пациентов по уровню полирезистентных возбудителей [20–22]. С учётом межквартального нарастания частоты потребления для амикацина, цефалоспоринов 3–4 поколения, фторхинолонов статистически незначимое нарастание индекса лекарственной устойчивости (ИЛУ) для E. coli и Klebsiella pneumoniae, Proteus mirabilis объясняется низкой потребляемостью антибактериальных препаратов в периоперационном периоде в соответствии с клиническими и методическими рекомендациями, плановостью многопрофильной медицинской организации, госпитализацией предлеченных антимикробными препаратами в предшествующие 90 дней. Таким образом, причина несоответствия относительного высокого ИП и относительно невысокого ИЛУ, за исключением Klebsiella pneumoniae (0,86), может предопределяться госпитализацией коморбидных пациентов с имеющимися факторами риска полирезистентных возбудителей, особенно в Covid-госпитале.
Заключение / Conclusion
Циркулирующий в стационарных условиях ФСНКЦ ФМБА спектр микроорганизмов, частота антибиотикорезистентности демонстрируют особенности прежде всего формирования формуляра антибактериальных препаратов с определёнными ограничениями в рамках риска — ориентированного подхода для сдерживания антибиотикорезистентности, что является наиболее приемлемым и часто используемым на практике [23].
По этой же причине важной составляющей при формировании формулярных перечней является дифференцированный подход в рамках структурных профилей оказания медицинской помощи с учётом данных локального микробиологического мониторинга и особенно реализации маркеров резистентности у микроорганизмов [24].
Таким образом, антибактериальные препараты, рассматриваемые клиническими рекомендациями Минздрава РФ в качестве стартовых, с учётом уровня продуцирования маркеров резистентности должны применяться в строгом соответствии с данными микробиологического исследования и/или согласно утверждённых и динамично изменяющихся локальных протоколов.
Высокая циркуляция в ФСНКЦ ФМБА штаммов микроорганизмов MDR/XDR/PDR предопределяет постоянство проведения микробиологического мониторинга и актуализацию схем персонализированной антибактериалной профилактики и терапии для высокорисковых процессов, связанных с применением антибактериальных препаратов.
Внедрение программы образовательных мероприятий по вопросам применения антимикробных препаратов также должно способствовать повышению эффективности и безопасности антимикробной терапии.
Автоматизация проведения и интерпретации результатов микробиологического мониторинга, системный глубокий SWOT-анализ (Strengths — сильные стороны; Weakness — слабые стороны; Opportunities — возможности внешней среды; Threats — угрозы внешней среды) составляющих эпидемиологической безопасности, использование программных продуктов в рамках поддержки принятия решений — мероприятия, которые должны лечь в основу программы по сдерживанию антимикробной резистентности и стратегического развития на региональном уровне.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов при подготовке данной статьи.
Участие авторов. Боброва О. П., Фетисов А. О. — написание текста, редактирование;
Зырянов С. К. — редактирование, финальное утверждение рукописи.
Финансирование. Работа выполнялась без спонсорской поддержки.
ADDITIONAL INFORMATION
Conflict of interest. The authors declare that there is no conflict of interest in the preparation of this article.
Participation of authors. Bobrova OP, Fetisov AO — writing the text, editing; Zyryanov SK — editing, final approval of the manuscript.
Financing. The work was carried out without sponsorship.
Список литературы
1. Насер Н.Р., Шляпников С.А., Попенко Л.Н. и др. Динамика антибиотикорезистентности актуальных для отделений интенсивной терапии и реанимации возбудителей анализ 10-летнего применения системы СКАТ (системы контроля за антибиотикорезистентностью). Неотложная хирургия им. И. И. Джанелидзе. 2021;(S2):54-55.
2. Сухорукова М.В., Эйдельштейн М.В., и др. Антибиотикорезистентность нозокомиальных штаммов Enterobacteriaceae в стационарах России: результаты многоцентрового эпидемиологического исследования «Марафон» 2013–2014. КМАХ. 2017;19-(1):49-56.
3. Яковлев С.В., Суворова М.П., Быков А.О. Инфекции, вызванные карбапенеморезистентными энтеробактериями: эпидемиология, клиническое значение и возможности оптимизации антибактериальной терапии. Антибиотики и Химиотерапия. 2020;65(5-6):41-69. doi: 10.37489/0235-2990-2020-65-5-6-41-69.
4. Сергевнин В.И., Кудрявцева Л.Г., Пегушина О.Г. Частота выявления и антибиотикорезистентность возбудителей гнойно-септических инфекций у пациентов кардиохирургического стационара. Эпидемиология и Вакцинопрофилактика. 2022;21(1):74-80. doi: 10.31631/2073-3046-2022-21-1-74-80.
5. Карноух К.И., Ших Е.В., Лазарева Н.Б. Индекс лекарственной устойчивости как критерий эффективности внедрения стратегии контроля антимикробной терапии. Клин фармакол тер. 2022;31(3):67-73. doi: 10.32756/0869-5490-2022-3-67-73.
6. Карпов О.Э., Гусаров В.Г., Замятин М.Н., и др. Управление антибиотикорезистентностью в стационаре: современные реалии и перспективы. КМАХ . 2020;22(4):277-286. doi: 10.36488/cmac.2020.4.277-286.
7. Кулагина Л.Ю., Валиуллина И.Р., Кадысева Э.Р., Шикалева А.А. Особенности антибиотикорезистентности по данным микробиологического мониторинга в многопрофильном стационаре. Прак-тическая медицина. 2021;19(4):79-83. doi: 10.32000/2072-1757-2021-4-79-83.
8. Митрохин С.Д., Орлова О.Е., Гостева И.В., Шкода А.С. Потребление антимикробных лекарственных средств в стационаре в зависимости от результатов микробиологического мониторинга ИСМП. Анти-биотики и Химиотерапия. 2020;65(9-10):21-27. doi: 10.37489/0235-2990-2020-65-9-10-21-27.
9. WHO Collaborating Centre for Drug Statistics Methodology, Guide-lines for ATC classification and DDD assignment, Oslo, 2021. Available at: https:///https://www.whocc.no/atc_ddd_index_and_guidelines/atc_ddd_index/
10. World Health Organization. Antimicrobial resistance. 2020. Available from: https://www.who.int/publications/i/item/global-action-plan-on-antimicrobial-resistance. [cited 2020, Dec 02
11. Хабалова Н.Р., Лялина Л.В., Кафтырева Л.А. Результаты эпидемиологического и микробиологического мониторинга инфекций, связанных с оказанием медицинской помощи, в Республике Северная Осетия – Алания. Здоровье населения и среда обитания. 2022;30(7):57-65. doi: 10.35627/2219-5238/2022-30-7-57-65.
12. Hovan MR, Narayanan N, Cedarbaum V, et al. Comparing mortality in patients with carbapenemase-producing carbapenem resistant Enterobacterales and non-carbapenemase-producing carbapenem resistant Enterobacterales bacteremia. Diagn Microbiol Infect Dis. 2021 Dec;101(4):115505. doi: 10.1016/j.diagmicrobio.2021.115505.
13. Тимофеева О.Г., Поликарпова С.В. Локальный микробиологический мониторинг штаммов Enterobacterales, продуцирующих карбапенемазы. Лабораторная служба. 2019;8(3):14-19. doi: 10.17116/labs2019803114.
14. Elshamy AA, Aboshanab KM. A review on bacterial resistance to carbapenems: epidemiology, detection and treatment options. Future Sci OA. 2020 Jan 27;6(3):FSO438. doi: 10.2144/fsoa-2019-0098.
15. Igbinosa O, Dogho P, Osadiaye N. Carbapenem-resistant Enterobacteriaceae: A retrospective review of treatment and outcomes in a long-term acute care hospital. Am J Infect Control. 2020 Jan;48(1):7-12. doi: 10.1016/j.ajic.2019.07.006.
16. Emeraud C, Escaut L, Boucly A, et al. Aztreonam plus Clavulanate, Tazobactam, or Avibactam for Treatment of Infections Caused by Metallo-β-Lactamase-Producing Gram-Negative Bacteria. Antimicrob Agents Chemother. 2019 Apr 25;63(5):e00010-19. doi: 10.1128/AAC.00010-19.
17. Lasko MJ, Nicolau DP. Carbapenem-Resistant Enterobacterales: Considerations for Treatment in the Era of New Antimicrobials and Evolving Enzymology. Curr Infect Dis Rep. 2020 Feb 7;22(3):6. doi: 10.1007/s11908-020-0716-3.
18. Lee NY, Tsai CS, Syue LS, et al. Treatment Outcome of Bacteremia Due to Non-Carbapenemase-producing Carbapenem-Resistant Klebsiella pneumoniae Bacteremia: Role of Carbapenem Combination Therapy. Clin Ther. 2020 Mar;42(3):e33-e44. doi: 10.1016/j.clinthera.2020.01.004.
19. Ackley R, Roshdy D, Meredith J, et al. Meropenem-Vaborbactam versus Ceftazidime-Avibactam for Treatment of Carbapenem-Resistant Enterobacteriaceae Infections. Antimicrob Agents Chemother. 2020 Apr 21;64(5):e02313-19. doi: 10.1128/AAC.02313-19.
20. Программа СКАТ (Стратегия Контроля Антимикробной Терапии) при оказании стационарной медицинской помощи: Российские клинические рекомендации / Под ред. С. В. Яковлева, Н. И. Брико, С. В. Сидоренко, Д. Н. Проценко. — М.: Издательство «Перо», 2018. — 156 с. doi: 10.17513/np.318.
21. Белобородов В.Б., Голощапов О.В., Гусаров В.Г. и др. Методические рекомендации Российской некоммерческой общественной организации «Ассоциация анестезиологов-реаниматологов», Межрегиональной общественной организации «Альянс клинических химиотерапевтов и микробиологов», Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), общественной организации «Российский Сепсис Форум» «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными штаммами микроорганизмов» (обновление 2022 г.). Вестник анестезиологии и реаниматологии. 2022;19(2):84-114. doi: 10.21292/2078-5658-2022-19-2-84-114 .
22. Зубрицкий В.Ф., Земляной А.Б., Михайлов Д.Ю., и др. Обобщение результатов создания формуляров антимикробной терапии на основе микробиологического мониторинга. Вестник Медицинско-го института непрерывного образования. 2023;3(2):46-52. EDN BWQGKC.
23. Березняк Е.А., Тришина А.В., Селянская Н.А., Симонова И.Р. Создание баз данных для систематизации результатов мониторинга антибиотикорезистентности. Здоровье населения и среда обитания. 2020;(4(325)):59-63.
24. Шлык И.В. Опыт внедрения системы контроля антимикробной тера-пии в многопрофильном стационаре. Вестник анестезиологии и реаниматологии . 2019;16 (6):60-66. Shlyk IV. Experience of introduction of the antimicrobial therapy control system in a general hospital. Messenger of Anesthesiology and Resuscitation. 2019;16(6):60-66. (In Russ.). doi: 10.21292/2078-5658-2019-16-6-60-66.
Об авторах
О. П. БоброваРоссия
Боброва Ольга Петровна, д. м. н., врач-клинический фармаколог; доцент кафедры фармакологии и клинической фармакологии с курсом ПО
Красноярск
А. О. Фетисов
Россия
Фетисов Александр Олегович, Главный врач
Красноярск
С. К. Зырянов
Россия
Зырянов Сергей Кенсаринович, д. м. н., профессор, зав. кафедрой общей и клинической фармакологии
Москва
Рецензия
Для цитирования:
Боброва О.П., Фетисов А.О., Зырянов С.К. Микробиологический мониторинг многопрофильной медицинской организации: основа стратегического планирования в рамках реализации эпидемиологической безопасности. Качественная клиническая практика. 2023;(4):86-95. https://doi.org/10.37489/2588-0519-2023-4-86-95
For citation:
Bobrova O.P., Fetisov A.O., Zyryanov S.K. Microbiological monitoring of a multidisciplinary medical organization: the basis of strategic planning in the framework of the implementation of epidemiological safety. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2023;(4):86-95. (In Russ.) https://doi.org/10.37489/2588-0519-2023-4-86-95














































