Перейти к:
Лекарственно-индуцированная лёгочная артериальная гипертензия
https://doi.org/10.37489/2588-0519-2022-1-53-63
Аннотация
Лёгочная артериальная гипертензия (ЛАГ) — состояние, которое характеризуется повышением среднего давления в лёгочной артерии. Данная патология ассоциирована с высокой смертностью, а специфическая терапия лёгочной артериальной гипертензии не влияет на причину заболевания и является чрезвычайно дорогостоящей. В связи с этим особенно важно изучение модифицируемых этиологических факторов ЛАГ. К одним из таких факторов относятся лекарственные средства. Одной из ведущих групп препаратов-индукторов является группа анорексигенных средств. Именно представители данной группы, такие как аминорекс, были первыми индукторами ЛАГ. Причём эта нежелательная реакция была настолько значимой, что привела к отзыву с рынка данных препаратов. В настоящее время ведущую роль в контексте лекарственно-индуцированной лёгочной гипертензии играют такие средства, как противоопухолевые, противовирусные препараты, а также интерфероны. Данные препараты приводят к лёгочной гипертензии путём различных патофизиологических механизмов. Ведущими мерами профилактики данной патологии являются ограничение применения препаратов-индукторов, снижение распространения ВИЧ-инфекции, так как для лечения ВИЧ-инфицированных пациентов может применяться несколько групп лекарственных средств, приводящих к развитию лёгочной гипертензии.
Ключевые слова
Для цитирования:
Остроумова О.Д., Листратов А.И., Кочетков А.И., Близнюк С.А., Комарова А.Г., Сычёв Д.А. Лекарственно-индуцированная лёгочная артериальная гипертензия. Качественная клиническая практика. 2022;(1):53-63. https://doi.org/10.37489/2588-0519-2022-1-53-63
For citation:
Ostroumova O.D., Listratov A.I., Kochetkov A.I., Bliznyuk S.A., Komarova A.G., Sychev D.A. Drug-induced pulmonary artery hypertension. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2022;(1):53-63. (In Russ.) https://doi.org/10.37489/2588-0519-2022-1-53-63
Введение / Introduction
Лёгочная артериальная гипертензия (ЛАГ) — гемодинамическое и патофизиологическое состояние, которое характеризуется повышением среднего давления в лёгочной артерии (ДЛА) ≥25 мм рт. ст. в покое, измеренного при чрезвенозной катетеризации сердца [1]. (Нормальное значение давления в лёгочной артерии в покое — среднее ДЛА ≥20 мм рт. ст. [2].)
Согласно данным регистров, заболеваемость ЛАГ варьирует от 1,1 до 2,4 случая на миллион случаев в год, распространённость составляет от 6,6 до 15 случаев [3]. ЛАГ характеризуется прогрессирующим тяжёлым поражением мелких сосудов и васкулопатией лёгких, приводящей к прогрессирующей правожелудочковой недостаточности и смерти пациентов с ЛАГ [4]. При агрессивном ведении пациентов с помощью комбинированной терапии пятилетняя выживаемость составляет 56 % [5]. Несмотря на разработку новых препаратов для лечения данного состояния, эти лекарственные средства (ЛС) являются вазодилататорами и не влияют на ключевые звенья патогенеза ЛАГ [6]. Данные препараты улучшают симптоматику и снижают частоту госпитализации, однако они не лечат заболевание и являются очень дорогими. Кроме того, методы лечения ЛАГ, которые имеются на данный момент, не продемонстрировали снижения смертности, которая остаётся на уровне 50 % в течение 5 лет [5]. Несмотря на то что частота госпитализации, ассоциированной с этим заболеванием, снизилась с начала века, средняя стоимость и продолжительность госпитализации увеличилась [7]. Согласно многим исследованиям, средняя стоимость лечения ЛАГ может достигать 120 тыс. долларов в год [8].
Таким образом, ЛАГ является значимой проблемой в клинической практике, для которой характерна высокая смертность и отсутствие этиотропного лечения. Поэтому необходимо изучение модифицируемых этиологических факторов ЛАГ. На сегодняшний день выявлено более 20 различных ЛС, приём которых ассоциирован с развитием первичной ЛАГ, в таком случае её принято называть лекарственно-индуцированной (ЛИ) [9–11], среди них анорексигенные, наркотические препараты и другие ЛС (см. табл. 1) [9–40]. Хотя клинические проявления и результаты клинико-инструментальных исследований в некоторых случаях не позволяют идентифицировать ЛИ ЛАГ от других форм ЛАГ, её клиническое течение и прогноз могут быть непредсказуемыми и у части больных определятся продолжительностью приёма препарата-индуктора. Помимо агрессивного лечения ЛАГ-специфической терапией, основной задачей в лечении ЛИ ЛАГ является раннее выявление ЛС, применение которых ассоциировано с развитием ЛАГ.
Таблица 1
Лекарственные средства, применение которых ассоциировано с развитием лекарственно-индуцированной лёгочной артериальной гипертензии [12–40]
Table 1
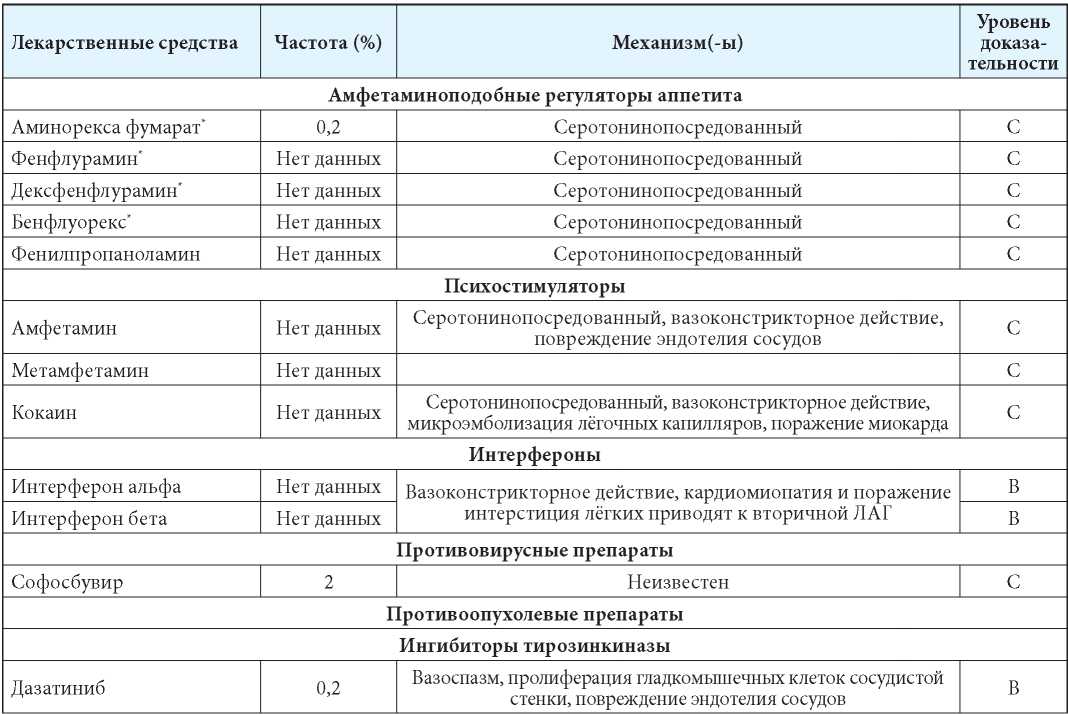

Примечания: уровни доказательности [41]: А — данные одного или нескольких рандомизированных контролируемых клинических исследований; уровень В — данные проспективных наблюдательных исследований, когортных исследований, исследований по типу «случай — контроль», метаанализов и (или) пострегистрационных исследований; уровень С — данные одного или нескольких опубликованных отчётов о случаях или серии случаев; * препараты отозваны с рынка в связи с развитием ЛАГ; ** в неонатологической практике, при применении ЛС матерью во время беременности; *** входит в состав средств китайской народной медицины; HER2 (human epidermal growth factor receptor 2) — рецептор эпидермального фактора роста, тип 2, VEGF (vascular endothelial growth factor) — фактор роста эндотелия сосудов.
Notes: levels of evidence [41]: А — data from one or more randomized controlled clinical trials; level В — data from prospective observational studies, cohort studies, case—control studies, meta-analyses and (or) post-registration studies; level С — data from one or more published case reports or a series of cases; * drugs withdrawn from the market due to the development of pulmonary arterial hypertension; ** in neonatology practice, when using drugs by a mother during pregnancy; *** is part of Chinese folk medicine; HER2 (human epidermal growth factor receptor 2) — epidermal growth factor receptor, type 2, VEGF (vascular endothelial growth factor) — vascular endothelial growth factor.
ЛС, применение которых ассоциировано с возникновением ЛАГ, суммированы в табл. 1 [12–40].
Проблема ЛИ ЛАГ нашла отражение как в европейских рекомендациях по диагностике и лечению ЛАГ 2015 г. [4], так и в рекомендациях Министерства здравоохранения России [1]. В этих документах среди факторов риска развития ЛАГ упоминаются ЛС. В зависимости от степени риска развития ЛАГ эксперты разделяют ЛС на «определённые» и «вероятные». К «определённым» ЛС относятся аминорекс, фенфлурамин, дексфенфлурамин, бенфлуорекс, дазатиниб, а также такие вещества, как метамфетамины, токсическое рапсовое масло. К группе «вероятных» — кокаин, фенилпропаноламин, зверобоя продырявленного трава, амфетаминоподобные препараты, интерферон α-2b и интерферон β-1a, алкилирующие препараты, бозутиниб, противовирусные препараты прямого действия. Кроме того, к «вероятным» факторам риска развития ЛАГ относится вещество индирубин, входящее в состав средств народной китайской медицины. Благодаря накопленным за последние годы данным, дазатиниб и метамфетамины из группы «вероятных» перенесены в группу «определённых» ЛС, с приёмом которых ассоциировано развитие ЛАГ [1].
Эпидемиология / Epidemiology
Распространённость ЛАГ в мире составляет около 1 % населения, в возрасте старше 65 лет встречаемость ЛАГ достигает 10 % пациентов [42]. Данные о распространённости ЛИ ЛАГ ограничены, так как установить причинно следственную связь между приёмом ЛС и возникновением ЛАГ часто затруднительно, расчётная распространённость ЛИ ЛАГ среди пациентов с ЛАГ составляет около 10 % [10]. Имеются данные о распространённости ЛИ ЛАГ среди больных с ВИЧ-инфекцией: её частота достигает 3–9,9 % [43][44]. В литературе также имеются ограниченные сведения о частоте возникновения данной нежелательной реакции (НР) на фоне приёма конкретных препаратов. Так, на фоне применения аминорекса, препарата из группы регуляторов аппетита, у одного или двух пациентов из тысячи развивалась ЛАГ [45]. Это значительно выше, чем первичная ЛАГ, распространённость которой оценивается в 1–2 случая на миллион [45]. В связи с отзывом с рынка препаратов данной группы больший интерес представляет распространённость ЛАГ на фоне применения препаратов, которые используются в настоящее время. Так, одной из установленных групп препаратов — индукторов ЛИ ЛАГ являются противоопухолевые средства. Частота ЛАГ на фоне приёма дазатиниба оценивается в 0,2 % [20]. Оценить распространённость данной НР на фоне других препаратов-индукторов не представляется возможным, так как сообщения о ней ограничены описанием отдельных клинических случаев или серии случаев.
Патофизиологические механизмы / Pathophysiological mechanisms
На сегодняшний день известно более 20 ЛС, которые способны приводить к развитию ЛИ ЛАГ [10]. Данные препараты могут быть сгруппированы в 7 классов (регуляторы аппетита — анорексигенные препараты; селективные ингибиторы обратного захвата серотонина (СИОЗС); амфетамин и его производные, а также кокаин; симпатомиметики; интерфероны; химиотерапевтические препараты; иммуномодуляторы; противовирусные препараты против вируса гепатита С прямого действия). Каждый из препаратов индуцирует ЛИ ЛАГ посредством тех или иных патогенетических механизмов, которые в отдельных случаях могут сочетаться между собой [10][11].
1. Механизм, опосредованный серотонинергическим и ему подобными эффектами.
Серотонин (син. 5-гидрокситрипамин) представляет собой вазоконстриктор и мощный митоген для гладкомышечных клеток сосудов лёгких [10]. Выраженность эффектов серотонина зависит от активности как его внутриклеточного транспортёра, так и серотониновых рецепторов. Последние представлены рядом подтипов, однако наиболее важными в контексте спазма сосудов малого круга кровообращения и пролиферации их гладких миоцитов имеют рецепторы 5-HT1B, реализующие своё действие при участии внутриклеточного транспортёра серотонина [46]. При участии данного транспортёра серотонин может вызывать вазоконстрикцию (и, как результат, повышение сосудистого сопротивления и рост давления в малом круге кровообращения) через активацию RhoA- и Roh-киназ и продукцию активных форм кислорода [10]. Рецептор 5-HT1B отвечает за фосфорилирование внеклеточной сигнал регулируемой киназы 1/2 (англ. extracellular signal-regulated kinase 1/2; ERK1/2), что также ведёт к образованию активных форм кислорода в лёгких [47]. Продукция данных радикалов, в особенности супероксиданион и пероксид водорода, обнаруживается в гладкомышечных клетках лёгких. Кроме того, на фоне подобных эффектов серотонина происходит повышение уровня окисленных форм протеин-тирозинфосфатаз и снижение содержания ядерного фактора-2 (англ. nuclear factor erythroid 2–related factor 2; Nrf-2), подобного эритроидному деривату 2, который представляет собой чувствительный к окислительно-восстановительному потенциалу транскрипционный фактор, защищающий клетки и ткани от окислительного стресса, действия токсинов и канцерогенов [10].
В дополнение к этому серотонин способен взаимодействовать с рецептором типа II белка костного морфогенеза (англ. bone morphogenetic protein receptor II; BMPRII), и в этом может состоять ещё один серотонинергический механизм индукции ЛАГ, в том числе ЛИ ЛАГ [48]. Термин «белок костного морфогенеза» объединяет группу сигнальных протеинов, выполняющих роль факторов роста для многих тканей организма [49]. При нарушении структуры и функции BMPRII возникает повышение продукции остеопротегерина (гликопротеина, относящегося к семейству рецепторов фактора некроза опухоли) и тенасцина С (представляет собой модулятор клеточной миграции, пролиферации и индуктор выработки провоспалительных цитокинов), что в итоге выражается в пролиферации гладких миоцитов лёгочного артериального русла [49]. У пациентов с ЛАГ повышен уровень остеопротегерина в зонах поражения лёгочных сосудов и в сыворотке крови; данный белок стимулирует деление гладкомышечных клеток и миграцию клеточных элементов. Тенасцин С активирует рецепторы гладких миоцитов стенки лёгочных сосудов к фактору роста и, таким образом, стимулирует их пролиферацию. При ЛАГ в циркулирующей крови у пациентов с наиболее тяжёлой клинической симптоматикой повышен также уровень и остеопонтина [49].
Следует отметить, что у пациентов с ЛАГ обнаруживается повышение образования серотонина в эндотелии сосудов лёгких, реализуемое при участии триптофангидроксилазы-1 [10]. Синтезируемый таким путём серотонин может по паракринному пути воздействовать на гладкие миоциты малого круга кровообращения [46][50]. У пациентов с ЛАГ доказано [10] наличие повышенной экспрессии внутриклеточных транспортёров серотонина и избыточный пролиферативный ответ на данный медиатор изолятов гладких миоцитов сосудов лёгких. Кроме того, возможность развития ЛАГ показана у лабораторных грызунов с избыточной представленностью внутриклеточных транспортёров серотонина [51], а у пациентов с хроническими заболеваниями лёгких была обнаружена тесная взаимосвязь между полиморфизмом гена транспортёров серотонина и тяжестью ЛАГ [52].
С точки зрения серотонинергических механизмов индукции ЛАГ особого внимания заслуживают анорексигенные препараты (аминорекс фумарат, фенфлурамин, дексфенлурамин, бенфлуорекс), большинство из которых являются субстратами транспортёров серотонина [10][11]. Данные ЛС могут проникать в клеточные элементы лёгких, где в зависимости от потенциала к кумуляции, профиля токсичности и индивидуальной предрасположенности пациента способны вызывать эффекты, подобные действию серотонина или даже превосходящие таковые, в том числе стимулируя митоз и потенцируя зависимую от функциональной активности транспортёров серотонина гиперплазию гладких миоцитов малого круга кровообращения [53][54].
Анорексигенные препараты могут действовать как непрямые агонисты рецепторов серотонина, подавляя обратный захват последнего и индуцируя его высвобождение из тромбоцитов [10]. В последующем серотонин активирует рецепторы, сопряжённые с Gi- и Gq-белками. Стимуляция Gi-белков в сочетании с активацией Gq-белков в разы усиливает ответ сосудов лёгочного круга кровообращения на вазоконстрикторные влияния за счёт интенсификации работы соответствующих внутриклеточных сигнальных путей (феномен фармакологического синергизма на уровне лёгочной циркуляции) [55]. Наконец, анорексигенные препараты способны также повышать экспрессию транспортёров серотонина, тем самым, как было описано выше, вызывая гиперплазию гладкомышечных клеток сосудов лёгких и индуцируя их ремоделирование, в финале приводящее к росту давления в малом круге кровообращения и развитию ЛАГ [10].
На метаболизм серотонина оказывают влияние и препараты, относящиеся к группе СИОЗС (флуоксетин, циталопрам, пароксетин, сертралин и др.) [10]. Указанные ЛС угнетают внутриклеточные транспортёры серотонина, тем самым подавляя его реабсорбцию в синапсах и повышая концентрацию медиатора на периферии [10]. Однако имеющиеся на сегодняшний день результаты исследований, в которых изучалась взаимосвязь между приёмом СИОЗС обратного захвата серотонина и риском ЛИ ЛАГ, противоречивы и не позволяют однозначно ответить на вопрос наличия такой ассоциированности [11].
Серотонинергический механизм является одной из составных частей комплексного механизма воздействия психоактивных и наркотических веществ (кокаина, амфетамина и его производных), ведущего к индукции ЛАГ [10, 11].
2. Прямое вазоконстрикторное действие на артериальное русло малого круга кровообращения.
Такой эффект может достигаться за счёт различных механизмов. Отдельные препараты (например, дексфенфлурамин, аминорекс и подобные ему анорексигенные препараты), помимо серотонинергических механизмов вазоспазма, способны напрямую ингибировать калиевые каналы в гладкомышечных клетках сосудов артериального русла малого круга кровообращения, на фоне чего в них повышается концентрация ионов кальция и происходит вазоспазм [10, 11].
Другие вещества (например, кокаин, амфетамин и его производные, интерфероны) вызывают вазоконстрикцию посредством повышения содержания эндоделина-1 в эндотелии сосудов лёгочной циркуляции, а также непосредственно в гладкомышечных клетках их стенок [56–58]. Фенилпропаноламин (син. норэфедрин), представляющий собой психоактивное вещество, а также обладающий деконгестантным и анорексигенным эффектами препарат, действует как неселективный α-адренэргический агонист и ингибитор обратного захвата норадреналина, и благодаря этому также может повышать тонус артериол лёгких [1]. Кокаин, кроме того, увеличивает экспрессию рецепторов эндотелина, снижает активность эндотелиальной NO-синтазы, уменьшая продукцию NO — универсального эндотелий-релаксирующего фактора — и тем самым ещё больше усугубляя вазоконстрикцию, повышая сосудистое сопротивление в малом круге кровообращения и увеличивая давление в нём [56][57].
Имеются данные, свидетельствующие о роли ряда ферментов, относящихся к группе тирозинкиназ, в индукции вазоспазма в малом круге кровообращения и стимуляции пролиферации гладкомышечных клеток в стенках сосудов [10]. Такие выводы были сделаны в силу описания случаев ЛИ ЛАГ на фоне применения препаратов из группы ингибиторов тирозинкиназ — дазатиниба, бозутиниба, иматиниба и нилотиниба [21][22][59]. Здесь следует указать, что нормальный сосудистый тонус в лёгочной циркуляции поддерживается благодаря функционированию ферментов, относящихся к семейству Src-тирозинкиназ («Src» — акроним от английского слова «sarcoma»), и их блокада будет вести к вазоспазму в лёгочном артериальном русле и развитию ЛАГ [60].
Существует ещё один механизм вазоконстрикции сосудов лёгочного круга кровообращения, он связан с угнетением образования простагландинов (прежде всего простагландина Е2), оказывающих в норме вазодилатирующий эффект. Таким способом могут индуцировать ЛАГ лефлуномид и противовирусный препарат софосбувир [56–58].
3. Повреждение эндотелия сосудов.
Такое действие оказывают различные группы препаратов и веществ, причём в довольно большом количестве случаев повреждение эндотелия сосудов представляет собой лишь отдельный компонент сложного механизма индукции ЛАГ конкретным ЛС.
Так, в частности, известно [16][61], что амфетамин и метамфетамин посредством индукции оксидативного стресса вызывают повреждения в ДНК эндотелиоцитов артериального русла лёгких, имеющие в дальнейшем определяющее значение в невозможности клетки поддерживать свою жизнеспособность. Интересно отметить, что в условиях нормального содержания кислорода в клетках эндотелия амфетамин не способен инициировать повреждение их генетического материала — данное вещество в большей степени выступает в роли амплификатора нарушений в структуре ДНК на фоне предсуществующей гипоксии [10].
Амфетамин угнетает митохондрии, вследствие чего происходит образование активных форм кислорода [62]. Высказывается предположение о значимости роли экспрессии ферментов, принимающих участие в метаболизме амфетамина и метамфетамина, как факторов, лимитирующих индукцию ЛАГ при употреблении данных веществ [10][11]. Здесь ключевая роль отводится карбоксилэстеразе-1. Существует мнение [63], что снижение экспрессии данного фермента ускоряет процесс развития метамфетамин-ассоциированной ЛАГ благодаря интенсификации апоптоза эндотелиоцитов в микроциркуляторном русле лёгких. Сходным образом через индукцию оксидативного стресса эндотелий лёгочных сосудов может повреждать ингибитор тирозинкиназ дазатиниб [64].
Повреждение эндотелия сосудов малого круга кровообращения, являющееся наиболее вероятной причиной индукции ЛАГ, наблюдается также при так называемом «синдроме токсического масла» (англ. “toxic oil syndrome”), суть которого состоит в развитии ЛАГ после контакта человека с рапсовым маслом, денатурированным при помощи анилина, и при синдроме «эозинофилии-миалгии», регистрировавшемся у пациентов, принимавших L-триптофан в качестве снотворного средства [11]. При обоих синдромах, как предполагается, токсическое влияния на эндотелиоциты оказывает общий метаболит — 3-анилино-L-аланин.
Повреждение сосудистого эндотелия не всегда ведёт именно к гибели эндотелиоцитов, в ряде случаев последствием этого процесса является повышение проницаемости сосудистой стенки. Считается, что такой механизм может играть роль в индукции ЛАГ при контакте с трихлорэтиленом [11]. С одной стороны, трихлорэтилен может являться фактором риска рассеянного склероза ввиду развития на фоне взаимодействия с ним нарушений в иммунной системе и аутоиммунных состояний с изменением соотношения Т-хелперы типа 17 / регуляторные Т-клетки [65]. С другой стороны, данное вещество вызывает оксидативный стресс с нарушением барьерной функции эндотелия и повышением проницаемости последнего [11], и если такая ситуация возникает на уровне лёгочного сосудистого русла, то создаются условия для контакта соединительнотканных и мышечных клеточных элементов лёгких с циркулирующими факторами роста, что, в свою очередь, ведёт к их неконтролируемой пролиферации и рекрутированию в ткани лёгких клеток воспаления с ремоделированием сосудистого русла и к профибротическим изменениям, которые являются весьма характерными находками у пациентов с ЛАГ [66][67].
4. Развитие лёгочной веноокклюзионной болезни.
Лёгочная веноокклюзионная болезнь (ЛВОБ) представляет собой редкий вариант ЛАГ и характеризуется ремоделированием и облитерацией лёгочных венул и вен и неблагоприятным прогнозом [10][11]. В общем виде ЛВОБ может возникать спорадически или передаваться по наследству в силу наличия биаллельной мутации в гене EIF2AK4, кодирующем киназу общего контроля с постоянной репрессией 2 (англ. general control nonderepressible-2; GCN2).
Среди ЛС ЛИ ЛАГ посредством развития ЛВОБ вызывают алкилирующие химиотерапевтические препараты (митомицин, кармустин, блеомицин, циклофосфамид), обладающие неспецифической цитотоксичностью [10][11]. Повреждение сосудов лёгких на фоне терапии митомицином характеризуется дисфункцией эндотелия, периваскулярным отёком, тромбообразованием в пульмональных капиллярах, гиперплазией интимы и гипертрофией медии артерий среднего калибра [10]. При моделировании на лабораторных грызунах интраперитонеальное введение митомицина сопровождалось развитием ЛВОБ, а также дозозависимым снижением содержания GCN2 в лёгких и супрессией сигнальных путей, опосредуемых белками SMAD 1/5/8 [68][69]. Наблюдаемые изменения в лёгких, ассоциированные с приёмом митомицина, вероятнее всего, обусловлены подавлением репликации ДНК вследствие ковалентного связывания препарата с ними и угнетением экспрессии сосудистого эндотелиального фактора роста [10].
Следует отметить, что развитие ЛВОБ вызывает также контакт с упоминавшимся выше трихлорэтиленом [10].
5. Механизмы, косвенным образом связанные с использованием препаратов/веществ (преимущественным образом применимо для наркотических субстанций).
- Микроэмболизация лёгочных капилляров и артериол посторонними примесями при в/в введении кокаина [10][11]. Последствием этого является развитие гранулематозного воспалительного процесса в сосудах лёгких с последующим повышением здесь сосудистого сопротивления.
- Изменения в лёгких на фоне вдыхания/курения наркотического вещества [10]. Такие изменения представлены повреждением дыхательных путей, включая развитие и обострение обструктивных заболеваний лёгких, отёком тканей последних с геморрагическими изменениями и повреждением слизистой оболочки носоглотки и верхних дыхательных путей.
- Сопутствующая ВИЧ-инфекция [10]. Как считается, ассоциированная с ВИЧ ЛАГ не является следствием прямой инвазии вируса в клеточные элементы сосудов лёгочного круга кровообращения [70]. Скорее, здесь имеет значение индуцируемое при участии белков ВИЧ Gp-120 и ТАТ-протеина образование активных форм кислорода с последующим повреждением эндотелия сосудов [10]. Дополнительными факторами служат индуцированная ВИЧ активация иммунной системы с повышенной секрецией провоспалительных цитокинов и факторов роста.
6. Поражение миокарда (преимущественным образом применимо для наркотических субстанций).
Хроническое употребление кокаина ассоциируется с развитием миокардита, гипертрофии миокарда, дилатационной кардиомиопатии и сердечной недостаточности [10]. В экспериментальных работах показано ухудшение систолической функции левого желудочка и повышение конечного диастолического давления в его полости на фоне введения кокаина [71]. В клинических исследованиях интракоронарная инфузия кокаина также вызывала ухудшение систолической и диастолической функции миокарда левого желудочка [10]. Все эти процессы, как известно, согласно законам гемодинамики также ведут к повышению давления в лёгочной артерии [72].
Факторы риска / Risk factors
Факторы риска развития ЛИ ЛАГ окончательно не установлены. Согласно литературным данным, в ряде случаев развитие ЛАГ на фоне приёма препаратов происходило у пациентов, которые имели факторы риска ЛАГ, такие как портальная гипертензия и ВИЧ-инфекция. Эти факторы риска, к примеру, встречались в случае развития ЛИ ЛАГ на фоне применения интерферона-α, софосбувира [73][74]: авторы подчёркивают хронологическую взаимосвязь между началом терапии препаратом-индуктором и выявлением ЛАГ.
Поскольку ЛИ ЛАГ развивается только у части людей, вполне вероятно, что в патогенезе развития ЛАГ немалую роль имеет генетическая предрасположенность. Согласно мнению некоторых исследователей, генетическая предрасположенность возможна, например, в случае ЛАГ, ассоциированной с применением интерферона-α [75]. Генетические полиморфизмы, влияющие на метаболизм серотонина, могут вносить вклад в развитие ЛАГ у детей [9]. Предполагается, что CES1 — ген, участвующий в метаболизме метамфетамина, — может играть роль в развитии ЛАГ на фоне применения данного средства [76, 77]. Мутации в рецепторе BMPR2 могут действовать в синергии с фенфлурамином и увеличивать риск развития тяжёлой ЛАГ [77]. Необходимо проведение дальнейших исследований, направленных на изучение генетических, биологических и клинических детерминант, обуславливающих индивидуальную предрасположенность к развитию ЛИ ЛАГ.
Клиническая картина, диагностика и дифференциальная диагностика / Clinical picture, diagnosis and diff erential diagnosis
Клиническая картина. Симптомы ЛИ ЛАГ, так же как и ЛАГ вследствие других причин, включают одышку при физической нагрузке, повышенную утомляемость, слабость, головокружение. На более поздних стадиях появляются синкопальные состояния, симптомы правожелудочковой сердечной недостаточности: отёки нижних конечностей, увеличение печени, асцит, пульсация вен шеи. Возможно появление болей в грудной клетке, кровохарканья. При аускультации сердца определяется акцент второго тона на лёгочной артерии, систолический шум трикуспидальной регургитации [1].
Диагностика. Выявление ЛИ ЛАГ основывается на оценке клинической картины, анамнеза приёма лекарственных препаратов, ассоциированных с развитием ЛАГ, и исключении других причин развития ЛАГ, в первую очередь заболеваний левых отделов сердца, патологии лёгких и хронической тромбоэмболической лёгочной гипертензии. Для определения вероятности ЛАГ применяется трансторакальная ЭхоКГ, для верификации диагноза и уточнения нозологической принадлежности — чрезвенозная катетеризация сердца [1]. Для подтверждения диагноза, определения тактики лечения, оценки степени гемодинамических нарушений, а также для проведения вазореактивного теста пациентам с подозрением на наличие ЛАГ рекомендуется проведение чрезвенозной катетеризации сердца [1]. Очень важным аспектом в диагностике лекарственно-индуцированного характера ЛАГ является временная связь между приёмом препарата-индуктора и развитием симптомов ЛАГ. Для определения причинно-следственной связи между приёмом ЛС и развитием ЛИ ЛАГ, так же как и в случае других ЛИ симптомов, синдромов и заболеваний, рекомендуется использовать шкалу Наранжо [78]. Очень важным в этой связи является тщательный сбор фармакологического анамнеза, для этого следует использовать специальные алгоритмы [41][79][80].
Дифференциальный диагноз необходимо проводить с другими причинами ЛАГ [1]:
- идиопатической ЛАГ;
- наследственной ЛАГ;
- ЛАГ, ассоциированной с системными заболеваниями соединительной ткани;
- ВИЧ-инфекцией;
- портальной гипертензией;
- врождёнными пороками сердца;
- шистосомозом;
- ЛАГ, ассоциированной с веноокклюзионной болезнью или гемангиоматозом лёгочных капилляров;
- ЛАГ, связанной с хронической обструктивной болезнью лёгких;
- рестриктивными заболеваниями лёгких;
- другими заболеваниями лёгких с рестриктивно-обструктивным паттерном;
- гипоксией без заболеваний лёгких;
- хронической тромбоэмболической ЛАГ;
- ЛАГ, ассоциированной с гематологическими
заболеваниями; - ЛАГ, обусловленной системными и метаболическими нарушениями;
- ЛАГ, связанной с патологией левых камер сердца;
- сердечно-сосудистой патологией, приводящей к посткапиллярной ЛАГ.
Лечение / Treatment
Стратегия лечения ЛИ ЛАГ зависит от тяжести заболевания. Однако, во всех случаях, лечение должно быть начато с выявления и отмены ЛС-индуктора. Терапия блокаторами кальциевых каналов показана пациентам с ЛАГ без клинических проявлений правожелудочковой сердечной недостаточности, имеющих положительный вазореактивный тест. Выбор препарата зависит от исходной частоты сердечных сокращений или наличия сопутствующей артериальной гипертензии: при склонности к синусовой тахикардии можно назначить дилтиазем, а пациентам с сопутствующей артериальной гипертензией — амлодипин или нифедипин.
У пациентов с ЛАГ, в том числе ЛИ ЛАГ, состояние которых соответствует III или IV ФК ВОЗ или если у пациента не наблюдается значимого улучшения гемодинамики (практически нормализации) на фоне терапии высокими дозами блокаторов кальциевых каналов, рекомендуется начинать ЛАГ-специфическую терапию [1]. В составе комбинированной специфической терапии в дополнение к пероральным препаратам возможно назначение илопроста в ингаляционной форме. Для лечения пациентов с ЛИ ЛАГ также возможно применение ЛАГ-специфической терапии антагонистом (блокатором) эндотелиновых рецепторов бозентаном и агонистом простациклиновых рецепторов селексипагом. Для профилактики тромбозов и тромбоэмболий у больных с ЛАГ, ассоциированной с приёмом препаратов для лечения ожирения центрального действия, рекомендована антикоагулянтная терапия антагонистами витамина К [1].
Профилактика / Prevention
Основными целями профилактики ЛИ ЛАГ является ограничение назначения ЛС, приём которых ассоциирован с развитием ЛАГ. Немаловажную часть занимает контроль оборота наркотических препаратов и профилактика распространения ВИЧ-инфекции. При выявлении ЛИ ЛАГ врачу необходимо зафиксировать этот факт в истории болезни и сообщить о выявленном осложнении фармакотерапии в соответствующие службы фармаконадзора [9][10][11].
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors state that there is no conflict of interest.
Список литературы
1. Авдеев С. Н., Барбараш О. Л., Баутин А. Е., Волков А. В., Веселова Т. Н., Галявич А. С., Гончарова Н. С., Горбачевский С. В., Данилов Н. М., Еременко А. А., Мартынюк Т. В., Моисеева О. М., Саидова М. А., Сергиенко В. Б., Симакова М. А., Стукалова О. В., Чазова И. Е., Чернявский А. М., Шалаев С. В., Шмальц А. А., Царева Н. А. Легочная гипертензия, в том числе хроническая тромбоэмболическая легочная гипертензия. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(12):4683. doi:10.15829/1560-4071-2021-4683
2. Kovacs G, Berghold A, Scheidl S, Olschewski H. Pulmonary arterial pressure during rest and exercise in healthy subjects: a systematic review. Eur Respir J. 2009;34(4):888–94. doi:10.1183/09031936.00145608
3. Thenappan T, Ryan JJ, Archer SL. Evolving epidemiology of pulmonary arterial hypertension [published correction appears in Am J Respir Crit Care Med. 2013;187(3):333]. Am J Respir Crit Care Med. 2012;186(8):707–9. doi:10.1164/rccm.201207-1266ED
4. Galiè N, Humbert M, Vachiery JL, et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). Eur Heart J. 2016;37(1):67–119. doi:10.1093/eurheartj/ehv317
5. Zelt JGE, Sugarman J, Weatherald J, et al. Mortality trends in pulmonary arterial hypertension in Canada: a temporal analysis of survival per ESC/ERS Guideline Era [published online ahead of print, 2021 Oct 21]. Eur Respir J. 2021;2101552. doi:10.1183/13993003.01552-2021
6. Thenappan T, Ormiston ML, Ryan JJ, Archer SL. Pulmonary arterial hypertension: pathogenesis and clinical management. BMJ. 2018;360:j5492. doi:10.1136/bmj.j5492
7. Anand V, Roy SS, Archer SL, et al. Trends and Outcomes of Pulmonary Arterial Hypertension-Related Hospitalizations in the United States: Analysis of the Nationwide Inpatient Sample Database From 2001 Th rough 2012. JAMA Cardiol. 2016;1(9):1021–9. doi:10.1001/jamacardio.2016.3591
8. Helgeson SA, Menon D, Helmi H, et al. Psychosocial and Financial Burden of Therapy in USA Patients with Pulmonary Arterial Hypertension. Diseases. 2020;8(2):22. doi:10.3390/diseases8020022
9. McGee M, Whitehead N, Martin J, Collins N. Drug-associated pulmonary arterial hypertension. Clin Toxicol (Phila). 2018;56(9):801–9. doi:10.1080/15563650.2018.1447119
10. Correale M, Tricarico L, Grazioli D, et al. Drug-Induced Pulmonary Arterial Hypertension: Mechanisms and Clinical Management. Cardiovasc Drugs Ther. 2019;33(6):725–38. doi:10.1007/s10557-019-06920-x
11. Ramirez RL 3rd, Pienkos SM, de Jesus Perez V, Zamanian RT. Pulmonary Arterial Hypertension Secondary to Drugs and Toxins. Clin Chest Med. 2021;42(1):19–38. doi:10.1016/j.ccm.2020.11.008
12. Weigle DS. Pharmacological therapy of obesity: past, present, and future. J Clin Endocrinol Metab. 2003;88(6):2462–9. doi:10.1210/jc.2003-030151
13. Abenhaim L, Moride Y, Brenot F, et al. Appetite-suppressant drugs and the risk of primary pulmonary hypertension. International Primary Pulmonary Hypertension Study Group. N Engl J Med. 1996;335(9):609–16. doi:10.1056/NEJM199608293350901
14. Dempsie Y, MacRitchie NA, White K, et al. Dexfenfluramine and the oestrogen-metabolizing enzyme CYP1B1 in the development of pulmonary arterial hypertension. Cardiovasc Res. 2013;99(1):24–34. doi:10.1093/cvr/cvt064
15. Savale L, Chaumais MC, Cottin V, et al. Pulmonary hypertension associated with benfluorex exposure. Eur Respir J. 2012;40(5):1164–72. doi:10.1183/09031936.00188611
16. Chen PI, Cao A, Miyagawa K, et al. Amphetamines promote mitochondrial dysfunction and DNA damage in pulmonary hypertension. JCI Insight. 2017;2(2):e90427. doi:10.1172/jci.insight.90427
17. Terra Filho M, Yen CC, Santos Ude P, Muñoz DR. Pulmonary alterations in cocaine users. Sao Paulo Med J. 2004;122(1):26–31. doi:10.1590/s1516-31802004000100007
18. Savale L, Sattler C, Günther S, et al. Pulmonary arterial hypertension in patients treated with interferon [published correction appears in Eur Respir J. 2015;46(6):1854]. Eur Respir J. 2014;44(6):1627–34. doi:10.1183/09031936.00057914
19. Caravita S, Secchi MB, Wu SC, Pierini S, Paggi A. Sildenafil therapy for interferon-β-1a-induced pulmonary arterial hypertension: a case report. Cardiology. 2011;120(4):187–9. doi:10.1159/000335064
20. Shah NP, Wallis N, Farber HW, et al. Clinical features of pulmonary arterial hypertension in patients receiving dasatinib. Am J Hematol. 2015;90(11):1060–4. doi:10.1002/ajh.24174
21. Minami M, Arita T, Iwasaki H, et al. Comparative analysis of pulmonary hypertension in patients treated with imatinib, nilotinib and dasatinib. Br J Haematol. 2017;177(4):578–87. doi:10.1111/bjh.14608
22. Hickey PM, Thompson AA, Charalampopoulos A, et al. Bosutinib therapy resulting in severe deterioration of pre-existing pulmonary arterial hypertension. Eur Respir J. 2016;48(5):1514–6. doi:10.1183/13993003.01004-2016
23. Quilot FM, Georges M, Favrolt N, et al. Pulmonary hypertension associated with ponatinib therapy. Eur Respir J. 2016;47(2):676–9. doi:10.1183/13993003.01110-2015
24. Low AT, Howard L, Harrison C, Tulloh RM. Pulmonary arterial hypertension exacerbated by ruxolitinib. Haematologica. 2015;100(6):e244–5. doi:10.3324/haematol.2014.120816
25. Gagnadoux F, Capron F, Lebeau B. Pulmonary veno-occlusive disease after neoadjuvant mitomycin chemotherapy and surgery for lung carcinoma. Lung Cancer. 2002;36(2):213–5. doi:10.1016/s0169-5002(01)00479-2
26. Ranchoux B, Günther S, Quarck R, et al. Chemotherapyinduced pulmonary hypertension: role of alkylating agents. Am J Pathol. 2015;185(2):356–71. doi:10.1016/j.ajpath.2014.10.021
27. Lafaras C, Mandala E, Verrou E, et al. Non-thromboembolic pulmonary hypertension in multiple myeloma, after thalidomide treatment: a pilot study. Ann Oncol. 2008;19(10):1765–9. doi:10.1093/annonc/mdn287
28. Liotta M, Rose PG, Escobar PF. Pulmonary hypertension in two patients treated with bevacizumab for recurrent ovarian cancer. Gynecol Oncol. 2009;115(2):308–9. doi:10.1016/j.ygyno.2009.08.003
29. Hainsworth JD, Fang L, Huang JE, et al. BRIDGE: an open-label phase II trial evaluating the safety of bevacizumab + carboplatin/paclitaxel as first-line treatment for patients with advanced, previously untreated, squamous non-small cell lung cancer. J Thorac Oncol. 2011;6(1):109–14. doi:10.1097/JTO.0b013e3181f94ad4
30. Simonneau G, Gatzoulis MA, Adatia I, et al. Updated clinical classification of pulmonary hypertension [published correction appears in J Am Coll Cardiol. 2014;63(7):746]. J Am Coll Cardiol. 2013;62(25 Suppl):D34–D41. doi:10.1016/j.jacc.2013.10.029
31. Mathew R, Huang J, Katta US, Krishnan U, Sandoval C, Gewitz MH. Immunosuppressant-induced endothelial damage and pulmonary arterial hypertension. J Pediatr Hematol Oncol. 2011;33(1):55–8. doi:10.1097/MPH.0b013e3181ec0ede
32. Alvarez PA, Saad AK, Flagel S, Mazzocchi O, Blanco MV. Leflunomide-induced pulmonary hypertension in a young woman with rheumatoid arthritis: a case report. Cardiovasc Toxicol. 2012;12(2):180–3. doi:10.1007/s12012-012-9153-3
33. Lazarevic VLj, Liljeholm M, Forsberg K, et al. Fludarabine, cyclophosphamide and rituximab (FCR) induced pulmonary hypertension in Waldenstrom macroglobulinemia. Leuk Lymphoma. 2008;49(6):1209–11. doi:10.1080/10428190802007718
34. Montrone D, Correale M, Franzese MG, Ieva R, Di Biase M, Capalbo SF. Pulmonary arterial hypertension in a chronic lymphocytic leukemia patient in treatment with rituximab. J Cardiovasc Med (Hagerstown). 2015;16(Suppl 1):S65. doi:10.2459/JCM.0b013e3283621adf
35. Ho RC, Ho EC, Tan CH, Mak A. Pulmonary hypertension in first episode infective endocarditis among intravenous buprenorphine users: case report. Am J Drug Alcohol Abuse. 2009;35(3):199–202. doi:10.1080/00952990902939719
36. Garrett PM. Tramadol overdose and serotonin syndrome manifesting as acute right heart dysfunction. Anaesth Intensive Care. 2004;32(4):575–7. doi:10.1177/0310057X0403200417
37. Freitas CF, Faro R, Dragosavac D, Clozel M, De Nucci G, Antunes E. Role of endothelin-1 and thromboxane A2 in the pulmonary hypertension induced by heparin-protamine interaction in anesthetized dogs. J Cardiovasc Pharmacol. 2004;43(1):106–12. doi:10.1097/00005344-200401000-00016
38. Evrard F, Dupuis M, Muller T, Jacquerye P. Hypertension artérielle pulmonaire isolée et pergolide [Isolated pulmonary hypertension and pergolide]. Rev Neurol (Paris). 2008;164(3):278–9. doi:10.1016/j.neurol.2007.09.005
39. Walker AM, Langleben D, Korelitz JJ, et al. Temporal trends and drug exposures in pulmonary hypertension: an American experience. Am Heart J. 2006;152(3):521–6. doi:10.1016/j.ahj.2006.02.020
40. Misumi K, Ogo T, Ueda J, et al. Development of Pulmonary Arterial Hypertension in a Patient Treated with Qing-Dai (Chinese Herbal Medicine). Intern Med. 2019;58(3):395–9. doi:10.2169/internalmedicine.1523-18
41. Tisdale JE, Miller DA. Drug Induced Diseases: Prevention, Detection, and Management. 3rd Ed. Bethesda, Md.: American Society of Health-System Pharmacists, 2018. 1399 рр.
42. Hoeper MM, Ghofrani HA, Grünig E, et al. Pulmonary Hypertension. Dtsch Arztebl Int. 2017;114(5):73–84. doi:10.3238/arztebl.2017.0073
43. Quezada M, Martin-Carbonero L, Soriano V, et al. Prevalence and risk factors associated with pulmonary hypertension in HIV-infected patients on regular follow-up. AIDS. 2012;26(11):1387–92. doi:10.1097/QAD.0b013e328354f5a1
44. Rasoulinejad M, Moradmand Badie S, Salehi MR, et al. Echocardiographic assessment of systolic pulmonary arterial pressure in HIV-positive patients. Acta Med Iran. 2014;52(11):827–30.
45. Orcholski ME, Yuan K, Rajasingh C, et al. Drug-induced pulmonary arterial hypertension: a primer for clinicians and scientists. Am J Physiol Lung Cell Mol Physiol. 2018;314(6):L967–L983. doi:10.1152/ajplung.00553.2017
46. MacLean MMR. The serotonin hypothesis in pulmonary hypertension revisited: targets for novel therapies (2017 Grover Conference Series). Pulm Circ. 2018;8(2):2045894018759125. doi:10.1177/2045894018759125
47. Hood KY, Mair KM, Harvey AP, et al. Serotonin Signaling Through the 5-HT1B Receptor and NADPH Oxidase 1 in Pulmonary Arterial Hypertension. Arterioscler Thromb Vasc Biol. 2017;37(7):1361–70. doi:10.1161/ATVBAHA.116.308929
48. Maclean MR, Dempsie Y. Th e serotonin hypothesis of pulmonary hypertension revisited. Adv Exp Med Biol. 2010;661:309–22. doi:10.1007/978-1-60761-500-2_20
49. Брегель Л. В., Белозеров Ю. М., Новиков П. В., Школьникова М. А. Генетика легочной гипертензии. Российский вестник перинатологии и педиатрии. 2014;59(1):22–7.
50. Pleym H, Greiff G, Mjorndal T, et al. Effect of serotonin reuptake inhibitors on pulmonary hemodynamics in humans. J Clin Med Res. 2011;3(5):230–8. doi:10.4021/jocmr654w
51. Guignabert C, Izikki M, Tu LI, et al. Transgenic mice overexpressing the 5-hydroxytryptamine transporter gene in smooth muscle develop pulmonary hypertension. Circ Res. 2006;98(10):1323–30. doi:10.1161/01.RES.0000222546.45372.a0
52. Adnot S, Houssaini A, Abid S, et al. Serotonin transporter and serotonin receptors. Handb Exp Pharmacol. 2013;218:365–80. doi:10.1007/978-3-642-38664-0_15
53. Dempsie Y, MacLean M. Role of the serotonin transporter in pulmonary arterial hypertension. Expert Rev Clin Pharmacol. 2008;1(6):749–57. doi:10.1586/17512433.1.6.749
54. Eddahibi S, Adnot S. Anorexigen-induced pulmonary hypertension and the serotonin (5-HT) hypothesis: lessons for the future in pathogenesis. Respir Res. 2002;3(1):9. doi:10.1186/rr181
55. MacLean MR. Pulmonary hypertension, anorexigens and 5-HT: pharmacological synergism in action? Trends Pharmacol Sci. 1999;20(12):490–5. doi:10.1016/s0165-6147(99)01389-9
56. Hendricks-Munoz KD, Gerrets RP, Higgins RD, et al. Cocaine-stimulated endothelin-1 release is decreased by angiotensin-converting enzyme inhibitors in cultured endothelial cells. Cardiovasc Res. 1996;31(1):117–23. doi:10.1016/s0008-6363(95)00168-9
57. Pradhan L, Mondal D, Chandra S, et al. Molecular analysis of cocaineinduced endothelial dysfunction: role of endothelin-1 and nitric oxide. Cardiovasc Toxicol. 2008;8(4):161–71. doi:10.1007/s12012-008-9025-z
58. George PM, Cunningham ME, Galloway-Phillipps N, et al. Endothelin-1 as a mediator and potential biomarker for interferon induced pulmonary toxicity. Pulm Circ. 2012;2(4):501–4. doi:10.4103/2045-8932.105039
59. Moslehi JJ, Deininger M. Tyrosine Kinase Inhibitor-Associated Cardiovascular Toxicity in Chronic Myeloid Leukemia. J Clin Oncol. 2015;33(35):4210–8. doi:10.1200/JCO.2015.62.4718
60. Groeneveldt JA, Gans SJ, Bogaard HJ, Vonk-Noordegraaf A. Dasatinibinduced pulmonary arterial hypertension unresponsive to PDE-5 inhibition. Eur Respir J. 2013;42(3):869–70. doi:10.1183/09031936.00035913
61. Ranchoux B, Meloche J, Paulin R, et al. DNA Damage and Pulmonary Hypertension. Int J Mol Sci. 2016;17(6):990. doi:10.3390/ijms17060990
62. Brown JM, Yamamoto BK. Effects of amphetamines on mitochondrial function: role of free radicals and oxidative stress. Pharmacol Ther. 2003;99(1):45–53. doi:10.1016/s0163-7258(03)00052-4
63. Orcholski ME, Khurshudyan A, Shamskhou EA, et al. Reduced carboxylesterase 1 is associated with endothelial injury in methamphetamineinduced pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 2017;313(2):L252–L266. doi:10.1152/ajplung.00453.2016
64. Guignabert C, Phan C, Seferian A, et al. Dasatinib induces lung vascular toxicity and predisposes to pulmonary hypertension. J Clin Invest. 2016;126(9):3207–18. doi:10.1172/JCI86249
65. Li S, Yu Y, Yang P, et al. Trichloroethylene Alters Th 1/Th 2/Th 17/Treg Paradigm in Mice: A Novel Mechanism for Chemically Induced Autoimmunity. Int J Toxicol. 2018;37(2):155–63. doi:10.1177/1091581818757036
66. Burton VJ, Ciuclan LI, Holmes AM, et al. Bone morphogenetic protein receptor II regulates pulmonary artery endothelial cell barrier function. Blood. 2011;117(1):333–41. doi:10.1182/blood-2010-05-285973
67. Huertas A, Perros F, Tu L, et al. Immune dysregulation and endothelial dysfunction in pulmonary arterial hypertension: a complex interplay. Circulation. 2014;129(12):1332–40. doi:10.1161/CIRCULATIONAHA.113.004555
68. Joselson R, Warnock M. Pulmonary veno-occlusive disease after chemotherapy. Hum Pathol. 1983;14(1):88–91. doi:10.1016/s0046-8177(83)80052-5
69. Wu KY, Wang HZ, Hong SJ. Mechanism of mitomycin-induced apoptosis in cultured corneal endothelial cells. Mol Vis. 2008;14:1705–12.
70. Kanmogne GD, Kennedy RC, Grammas P. Analysis of human lung endothelial cells for susceptibility to HIV type 1 infection, coreceptor expression, and cytotoxicity of gp120 protein. AIDS Res Hum Retroviruses. 2001;17(1):45–53. doi:10.1089/088922201750056771
71. Mehta PM, Grainger TA, Lust RM, et al. Effect of cocaine on left ventricular function. Relation to increased wall stress and persistence after treatment. Circulation. 1995;91(12):3002–9. doi:10.1161/01.cir.91.12.3002
72. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083
73. Savale L, Chaumais MC, O’Connell C, et al. Interferon-induced pulmonary hypertension: an update. Curr Opin Pulm Med. 2016;22(5):415–20. doi:10.1097/MCP.0000000000000307
74. Renard S, Borentain P, Salaun E, et al. Severe Pulmonary Arterial Hypertension in Patients Treated for Hepatitis C With Sofosbuvir. Chest. 2016;149(3):e69–e73. doi:10.1016/j.chest.2015.09.018
75. Dhillon S, Kaker A, Dosanjh A, et al. Irreversible pulmonary hypertension associated with the use of interferon alpha for chronic hepatitis C. Dig Dis Sci. 2010;55(6):1785–90. doi:10.1007/s10620-010-1220-7
76. Funakoshi-Hirose I, Aki T, Unuma K, et al. Distinct effects of methamphetamine on autophagy-lysosome and ubiquitin-proteasome systems in HL-1 cultured mouse atrial cardiomyocytes. Toxicology. 2013;312:74–82. doi:10.1016/j.tox.2013.07.016
77. Humbert M, Deng Z, Simonneau G, et al. BMPR2 germline mutations in pulmonary hypertension associated with fenfluramine derivatives. Eur Respir J. 2002;20(3):518–23. doi:10.1183/09031936.02.01762002
78. Naranjo C, Busto U, Sellers E, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30(2):239–45. doi:10.1038/clpt.1981.154
79. Сычев Д. А., Остроумова О. Д., Переверзев А. П. и др. Лекарственно-индуцированные заболевания: подходы к диагностике, коррекции и профилактике. Фармаконадзор. Фарматека. 2020;(6):113–26. doi:10.18565/pharmateca.2020.6.113-126
80. Лекарственнo-индуцированные заболевания. Том I: монография / В. А. Дё, К. А. Загородникова, Д. В. Иващенко и др.; под науч. ред. Сычева Д. А., Остроумовой О. Д., Переверзева А. П. – М.: Прометей, 2022. – 540 с.
Об авторах
О. Д. ОстроумоваРоссия
Остроумова Ольга Дмитриевна - д. м. н., профессор, зав. кафедрой терапии и полиморбидной патологии имени академика М. С. Вовси ФГБОУ ДПО РМАНПО Минздрава РФ; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский университет)
SPIN-код: 3910-6585
Москва
А. И. Листратов
Россия
Листратов Александр Иванович - ординатор 2-го года кафедры терапии и полиморбидной патологии имени академика М. С. Вовси
Москва
А. И. Кочетков
Россия
Кочетков Алексей Иванович - к. м. н., доцент кафедры терапии и полиморбидной патологии имени академика М. С. Вовси
SPIN-код: 9212-6010
Москва
С. А. Близнюк
Россия
Близнюк Светлана Александровна - к. м. н., врач-кардиолог, кардиологическое отделение для больных с острым инфарктом миокарда № 28
Москва
А. Г. Комарова
Россия
Комарова Анна Григорьевна - к. м. н., зам. главного врача
SPIN-код: 3092-6789
Москва
Д. А. Сычёв
Россия
Сычёв Дмитрий Алексеевич - д. м. н., профессор, член-корр. РАН, ректор, зав. кафедрой клинической фармакологии и терапии имени академика Б. Е. Вотчала
SPIN-код: 4525-7556
Москва
Рецензия
Для цитирования:
Остроумова О.Д., Листратов А.И., Кочетков А.И., Близнюк С.А., Комарова А.Г., Сычёв Д.А. Лекарственно-индуцированная лёгочная артериальная гипертензия. Качественная клиническая практика. 2022;(1):53-63. https://doi.org/10.37489/2588-0519-2022-1-53-63
For citation:
Ostroumova O.D., Listratov A.I., Kochetkov A.I., Bliznyuk S.A., Komarova A.G., Sychev D.A. Drug-induced pulmonary artery hypertension. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2022;(1):53-63. (In Russ.) https://doi.org/10.37489/2588-0519-2022-1-53-63














































