Перейти к:
Взаимодействие пищевых продуктов и лекарственных средств как фактор риска развития лекарственно индуцированных заболеваний: эпидемиология, факторы риска, потенциальные механизмы развития взаимодействий
https://doi.org/10.37489/2588-0519-2021-3-31-38
Аннотация
Введение любого лекарственного средства (ЛС) потенциально ассоциировано с риском развития нежелательных реакций (НР), частота возникновения которых в развитых и развивающихся странах оценивается в 6,3 (3,3—11,0) и 5,5 % (1,1—16,9) соответственно. Многие НР повышают смертность и/или заболеваемость и/или становятся причиной возникновения клинических проявлений, требующих обращения пациента за медицинской помощью или госпитализации. Был введён специальный термин — «лекарственно индуцированные заболевания» (англ. druginduced diseases). Продукты питания могут взаимодействовать с ЛС и повышать риски развития НР, в том числе серьёзных НР. Приём как пищи в целом, так и определённых продуктов питания одновременно с некоторыми лекарствами может влиять на общую биодоступность, фармакокинетику, фармакодинамику и терапевтическую эффективность лекарств за счёт изменений абсорбции и метаболизма ЛС. Ярким примером влияния пищи на фармакокинетический профиль ЛС является изменение биодоступности ингибитора тирозинкиназы лапатиниба: по сравнению с приёмом натощак биодоступность лапатиниба в разовой дозе 1 500 мг после приёма его вместе с высококалорийной стандартной пищей увеличивается в среднем на 325 % — в 4,25 раза. Другими словами, концентрация препарата в сыворотке крови после приёма одной таблетки одновременно с пищей сопоставима с приёмом 4 таблеток натощак. В настоящее время отсутствуют рекомендации по выбору режима дозирования ЛС в зависимости от качественного и количественного состава пищи, а также учитывающего потенциальные взаимодействия с компонентами пищи, хотя данные рекомендации крайне необходимы пациентам и специалистам практического здравоохранения. В связи с этим в данной статье суммированы имеющиеся на момент написания в открытых источниках данные, касающиеся влияния продуктов питания на абсорбцию и метаболизм ЛС, а также описаны возможные механизмы взаимодействия.
Ключевые слова
Для цитирования:
Переверзев А.П., Остроумова О.Д. Взаимодействие пищевых продуктов и лекарственных средств как фактор риска развития лекарственно индуцированных заболеваний: эпидемиология, факторы риска, потенциальные механизмы развития взаимодействий. Качественная клиническая практика. 2021;(3):31-38. https://doi.org/10.37489/2588-0519-2021-3-31-38
For citation:
Pereverzev A.P., Ostroumova O.D. Food-drug interaction as a risk factor of drug-induced diseases: epidemiology, risk factors, potential mechanisms of interaction. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):31-38. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-31-38
Введение / Introduction
Введение любого лекарственного средства (ЛС) потенциально ассоциировано с риском развития нежелательных реакций (НР), частота возникновения которых в развитых и развивающихся странах оценивается в 6,3 (3,3–11,0) и 5,5 % (1,1–16,9) соответственно [1]. По данным ряда авторов, наиболее часто осложнения фармакотерапии развиваются со стороны центральной нервной системы (ЦНС), желудочно-кишечного тракта (ЖКТ) и сердечнососудистой системы (ССС) [1, 2]. В связи с тем, что многие НР повышают смертность и/или заболеваемость и/или становятся причиной возникновения клинических проявлений, требующих обращения пациента за медицинской помощью или госпитализации, был введён специальный термин — «лекарственно индуцированные заболевания» (ЛИЗ, англ. drug-induced diseases) [3]. Выделают ряд немодифицируемых (например, возраст, женский пол) и модифицируемых факторов, повышающих риск их развития [4][5]. Одним из модифицируемых факторов риска развития лекарственно индуцированных заболеваний является взаимодействие лекарственных препаратов и пищевых продуктов, кроме того подобное взаимодействие может снижать эффективность фармакотерапии [3]. Продукты питания могут взаимодействовать с ЛС и повышать риски развития НР, в том числе серьёзных НР и ЛИЗ. Приём как пищи в целом, так и определённых продуктов питания одновременно с некоторыми ЛС может влиять на общую биодоступность, фармакокинетику, фармакодинамику и терапевтическую эффективность медикаментов. Понимание механизмов, лежащих в основе данного взаимодействия, важно для разработки мер профилактики НР и безопасного применения ЛС [6].
Эпидемиология / Epidemiology
Точных данных об эпидемиологии и распространённости случаев взаимодействия ЛС и продуктов питания в клинической практике нет, а литературные данные ограничены [6][7–12].
По данным Kang SP и Ratain MJ [7], 34 из 99 ЛС, получивших одобрение Управления по контролю за продуктами питания и лекарственными средствами США (United States Food and Drug administration, US FDA) в период с января 2000 г. по май 2009 г., имели риски клинически значимого взаимодействия с пищевыми продуктами [7]. В частности, многие противоопухолевые препараты (например, афатиниб, акситиниб, кабозантиниб, эрлотиниб, иматиниб, сорафениб, сунитиниб и др.) вследствие низкой растворимости в воде в эксперименте продемонстрировали изменение биодоступности при одновременном приёме с пищей [8].
В кросс-секционном описательном исследовании Abdollahi M и соавт. [9], в которое вошли медицинские данные 400 пациентов, находившихся на стационарном лечении, изучались риски развития потенциальных взаимодействий между пищевыми продуктами и ЛС. Из 19 наиболее часто назначаемых ЛС (карведилол, диклофенак, изосорбида динитрат, магния гидроксид, спиронолактон, ранитидин, нитроглицерин, комбинация гидрохлоротиазид + триамтерен, метронидазол, железа сульфат, метопролол, ко-тримоксазол, каптоприл, ацетилсалициловая кислота (АСК), омепразол, амиодарон, комбинация клидиния бромид + хлордиазепоксид, ловастатин, пропранолол) 17 (кроме магния гидроксида и АСК) назначались без учёта времени приёма пищи, а потому имели высокие риски взаимодействий и, как следствие, изменения профилей эффективности и безопасности, например за счёт колебаний концентрации ЛС в плазме крови. Лидерами по числу назначений без учёта потенциальных взаимодействий с пищей были нитроглицерин, метронидазол (100 % случаев для обоих ЛС), каптоприл (86,7 %) и сульфат железа (83,8 %) [10].
R. E. F. L. de Carvalho и соавт. [10] с помощью специального программного обеспечения Drug Reax® проанализировали распространённость потенциальных взаимодействий ЛС с препаратами для энтерального питания через 24 и 120 часов госпитализации в отделение реанимации и интенсивной терапии. Энтеральное питание в течение первых 24 часов получали 28,5 % пациентов, а через 120 часов — 44,8 %, при этом количество случаев взаимодействий ЛС и препаратов для энтерального питания составило 6,3 % через 24 часа и 7,7 % — через 120 часов [10].
S. J. F. Neves и соавт. [11] изучали распространённость потенциальных взаимодействий между ЛС и продуктами питания в группе пациентов пожилого и старческого возраста (n=342). Потенциальные взаимодействия с пищевыми продуктами определялись с помощью программного комплекса MICROMEDEX® Interaction. Распространённость потенциальных взаимодействий «ЛС-пища» составила 58,5 %, при этом максимальные риски развития НР вследствие подобного взаимодействия присутствовали у больных, принимавших одновременно с пищей несколько ЛС. Среди назначений чаще других встречались следующие группы ЛС с высоким потенциальным риском взаимодействия с пищевыми продуктами: cахароснижающие ЛС (6,8 %), антигипертензивные препараты (в том числе диуретики (13 %), блокаторы ренин-ангиотензин-альдостероновой системы (11,2 %), бета-адреноблокаторы (2 %)), а также анальгетики (8,4 %). Среди конкретных ЛС с высокими рисками развития потенциальных НР вследствие взаимодействия с продуктами питания по частоте назначений лидировали каптоприл (36,3 %), пропранолол (17,9 %), метформин (15,1 %), алендронат (6,5 %) и фуросемид (2,1 %) [11].
Факторы риска развития взаимодействий между продуктами питания и ЛС / Risk factors for drug-food interactions
В работе Abdollahi M и соавт. [9] при проведении множественной логистической регрессии после внесения поправок на искажающие факторы выявлено, что статистически значимо ассоциированы с более высоким риском потенциальных взаимодействий пищевых продуктов и ЛС были возраст [β=0,005, CI: 0,0–0,01; P=033], одновременный приём большого количества ЛС [β=0,1, ДИ: 0,083–0,117; P<0,001] и длительность патологического состояния/заболевания (чем дольше оно сохраняется / не купируется, тем выше риски) [β=–0,037, CI: от –0,05 до –0,023; P<0,001]. Также наиболее часто клинически значимые взаимодействия ЛС и пищи наблюдались у женщин и лиц с низким уровнем образования [9]. Аналогичные данные были получены Neves SJF и соавт. [11], которые пришли к выводу, что полипрагмазия, одновременный приём ЛС и пищи, отсутствие консультирования по вопросам правильного приёма ЛС, а также наличие некоторых хронических заболеваний (сахарный диабет) повышают риски развития НР вследствие взаимодействия ЛС и продуктов питания [11].
Потенциальные механизмы развития взаимодействий ЛС и пищи / Potential mechanisms for drug-food interactions
Выделяют 2 основных типа взаимодействия ЛС и пищи: фармакокинетический (на уровне всасывания, распределения, метаболизма и выведения) и фармакодинамический (на уровне рецепторов и фармакологических эффектов) [6].
Фармакокинетический тип взаимодействия ЛС и продуктов питания / Pharmacokinetic drug-food interactions
Изучение влияния продуктов питания или напитков на фармакокинетический профиль ЛС является неотъемлемой частью процесса регистрации нового лекарственного препарата. Как правило, оценивается биодоступность ЛС в эксперименте с участием здоровых добровольцев, в котором определяется концентрация испытуемого ЛС в плазме крови за определённый временной промежуток натощак и после одновременного приёма с пищей [6].
Так как биодоступность ЛС при его приёме одновременно с пищей сильно зависит от его количественного и химического состава, Управление по контролю за продуктами питания и лекарственными средствами США (US FDA) в 2002 г. выпустило руководство по проведению исследований биодоступности и биоэквивалентности ЛС на фоне приёма пищи (FDA, 2002), что позволило стандартизировать качественный и количественный состав пищи в условиях эксперимента. Несколько позже аналогичные документы были приняты Европейским медицинским агентством (European Medicines Agency, EMA) и Евразийской экономической комиссией [6][12][13].
Согласно данным документам, пища, принимаемая добровольцами в эксперименте, должна быть высококалорийной (800–1000 ккал) и жирной (500–600 ккал от общего количества калорий должны быть получены из жиров) [6][12][13]. В руководствах FDA и EMA также приведён пример рациона, соответствующего данным требованиям: два ломтика тоста со сливочным маслом, два ломтика жареного бекона, два яйца, обжаренные на сливочном масле, 113 г картофельных оладий, 240 мл цельного молока [6][12][13].
Ярким примером влияния пищи на фармакокинетический профиль ЛС является изменение биодоступности ингибитора тирозинкиназы лапатиниба: по сравнению с приёмом натощак биодоступность лапатиниба в разовой дозе 1 500 мг после приёма его вместе с высококалорийной стандартной пищей увеличивается в среднем на 325 % — в 4,25 раза (!) [14]. Другими словами, концентрация препарата в сыворотке крови после приёма одной таблетки одновременно с пищей сопоставима с приёмом 4 таблеток натощак. Фармакокинетика другого противоопухолевого препарата вемурафениба также изменяется на фоне одновременного приёма с пищей (площадь под кривой (AUC) увеличивается примерно в 5 раз при приёме с пищей). Тем не менее в инструкции по медицинскому применению, утверждённой ЕМА, говорится о том, что данный препарат «можно принимать независимо от приёма пищи, однако предпочтительнее избегать приёма препарата на голодный желудок», хотя на самом деле в случае приёма этого препарата одновременно с пищей требуется приём более низких доз препарата [6].
В настоящее время отсутствуют рекомендации по выбору режима дозирования ЛС в зависимости от качественного и количественного состава пищи, а также учитывающего потенциальные взаимодействия с компонентами пищи, хотя данные рекомендации крайне необходимы пациентам и специалистам практического здравоохранения [6].
Продукты питания могут изменять абсорбцию, метаболизм, распределение и выведение ЛС.
Влияние пищи на абсорбцию ЛС / Effect of food on drug absorption
После физической и химической обработки в ротовой полости и желудке съеденная пища попадает в кишечник, где происходит её всасывание и частично метаболизм. Транспорт любых молекул через биологические мембраны (в том числе продуктов питания и ЛС) может происходить путём пассивного (по градиенту концентрации, без затрат энергии) или активного (с помощью белков-переносчиков, с затратами энергии) транспорта [6][15]. Поскольку для всасывания молекул ЛС и продуктов питания используются одни и те же пути и белки-транспортеры, взаимодействие продуктов питания и ЛС вследствие конкуренции неизбежно [16].
Взаимодействие на уровне белков-переносчиков / drug-food interaction involving plasma proteins
Органические анион-транспортирующие полипептиды (OATP) / Organic Anion Transporting Polypeptides
Одними из основных транспортных белков, на уровне которых возможно взаимодействие продуктов питания и ЛС, является семейство органических анион-транспортирующих полипептидов (Organic Anion Transporting Polypeptides, OATР), которые представляют собой семейство белков-транспортёров, локализующихся в печени и кишечнике. OATP участвуют в транспорте эндогенных субстратов, включая желчные кислоты, гормоны щитовидной железы, простагландины, глюкурониды, билирубин, а также всасывании продуктов питания и ЛС [17]. В частности, OATP2B1 (и в меньшей степени OATP1A2) присутствует на апикальной мембране кишечных энтероцитов и принимает активное участие в pH-зависимой абсорбции как питательных веществ, так и лекарств-субстратов (статины, ингибиторы протеаз, фексофенадин, мидазолам, монтелукаст, алискирен и талинолол) из пищеварительного тракта [18]. Многочисленные исследования на людях доказали клинически значимое снижение кишечной абсорбции этих препаратов при приёме внутрь одновременно с грейпфрутовым, апельсиновым и яблочным соками, обусловленное, по всей видимости, наличием в них большого количества флавоноидов [19][20]. В in vitro экспериментах было обнаружено, что флавоноловые гликозиды и катехины, присутствующие в экстрактах трав и зелёном чае, а также некоторые красители, подсластители и консерванты, используемые в пищевой промышленности (например, куркумин, бриллиантовый синий, бриллиантовый чёрный и др.), также способны ингибировать OATP [21]. В работах Dresser GK и соавт. [22] было показано снижение биодоступности фексофенадина (субстрат ОАТP и P-gp), на фоне одновременного приёма с фруктовым соком из-за более выраженного ингибирования ОАТР по сравнению с P-gp [22].
Переносчик пептидов 1 (PepT 1) / Oligopeptide transporter
Переносчик пептидов 1 (PерT 1) в основном локализуется в апикальных мембранах эпителиальных клеток кишечника и участвует в абсорбции ди- и трипептидов и ЛС-субстратов, в том числе β-лактамных антибиотиков, цефалоспоринов, леводопы, ингибиторов ангиотензинпревращающего фермента (иАПФ) [6]. В работе Tsui JK и соавт. [23] было показано, что у пациентов с болезнью Паркинсона, принимавших леводопу, эффективность терапии была выше на фоне рациона с низким содержанием белка по сравнению с пациентами, принимавшими высокобелковую пищу [23]. При этом наблюдаемые изменения не коррелировали с концентрацией леводопы в сыворотке крови [23]. Кроме того, в экспериментах на моделях животных (мыши и рыбки данио) было показано, что голодание увеличивает транскрипцию PерT 1, что теоретически может приводить к усилению всасывания ЛС-субстратов [24].
P-гликопротеин (P-gp) / P-glycoprotein
Р-гликопротеин является одним из наиболее изученных белков-переносчиков, для которого известен целый ряд клинически значимых взаимодействий ЛС с пищевыми продуктами, из которых наиболее хорошо изучены взаимодействия с грейпфрутовым соком и зверобоем продырявленным, который в России заваривали как чай и пили как с лечебной целью, так и просто как приятный напиток. В настоящее время зверобой входит в состав многих биологически активных добавок (БАД), которые в соответствии с законодательством Российской Федерации относятся к продуктам питания [25]. P-gp локализуется в большом количестве тканей, в том числе ЖКТ [26]. Субстратами P-gp являются многие антиаритмические препараты, дигоксин, некоторые антигипертензивные препараты, циклоспорин, такролимус, фексофенадин, морфин и др. [6]. Фуранокумарины и флавоноиды, присутствующие в большом количестве во фруктах и овощах, считаются основными ингибиторами P-gp [27].
Другие белки-переносчики / Other protein-transporters
В апикальной мембране энтероцитов помимо P-gp экспрессируются и другие белки множественной лекарственной резистентности (multidrug resistanceassociated protein, MRP), в том числе белок устойчивости рака молочной железы (breast cancer resistance protein, BCRP), которые задействованы в транспорте конъюгированных метаболитов, включая производные глутатиона, глюкурониды и др. [28]. Флавоноиды являются обычными ингибиторами этих переносчиков. Так, van Zanden JJ и соавт. [29] обнаружили, что метаболиты кверцетина (флавоноид, содержащийся в каперсах, гречневой крупе, луке (особенно красном), яблоках, перце, чесноке, золотом усе, красном винограде, чае, цитрусовых и др. продуктах), образующиеся во время второй фазы метаболизма, особенно глюкурониды, являются мощными ингибиторами MRP in vitro [29]. Chalet С и соавт. [30] наблюдали ускоренное образование и экскрецию данных метаболитов на апикальной мембране энтероцитов в тонком кишечнике добровольцев после приёма кверцетина [30].
BCRP также участвует в транспорте конъюгированных метаболитов, однако данные, подтверждающие это in vivo, ограничены [31]. Субстратами BCRP являются образующиеся в процессе метаболизма статинов, стероидных гормонов, фолиевой кислоты, витаминов B2 и K3 (менадион, ахинон) конъюгаты, например с сульфатами, полиглутаматом, бензо[а]пиреном, глюкуроновой кислотой и др. [32]. Для изучения потенциальной роли этого белка в процессах взаимодействия ЛС и продуктов питания требуются дальнейшие исследования.
Изменение подвижности мембран / Changes in membrane fluidity
Молекулы, которые увеличивают подвижность («текучесть») мембран энтероцитов, теоретически могут влиять на абсорбцию ЛС за счёт увеличения скорости диффузии ЛС [33]. Так, флавоноиды, холестерин и альфа-токоферол встраиваются в клеточные мембраны, изменяя их конфигурацию, хотя клиническая значимость этого феномена пока не известна [34].
Влияние пищи на метаболизм ЛС / The effect of food on drug metabolism
Основной системой, осуществляющей метаболизм ЛС в организме, является цитохром Р-450 (CYP) — семейство ферментов, локализованных преимущественно в печени, но также экспрессируемых клетками ЖКТ [6][15]. Энтероциты обычно являются первым местом метаболизма ЛС, принятых внутрь. Основными (<95 %) изоферментами CYP, экспрессируемыми в тонком кишечнике человека, являются CYP3A и CYP2C9 [35]. Именно CYP3A энтероцитов опосредует пресистемный метаболизм некоторых ЛС, например циклоспорина, верапамила, фелодипина, мидазолама, такролимуса, симвастатина, нифедипина, интенсивность которого может быть усилена индукторами этих ферментов, такими как рифампицин [6][35][36] (таблица 1).
Таблица 1
Примеры ЛС — субстратов некоторых изоферментов цитохрома Р-450, локализованных в стенке кишечника [6][35][36]
Table 1
Examples of drugs — substrates of some cytochrome P-450 isoenzymes localized in the intestinal wall [6][35][36]

Примечания: CYP — цитохром Р-450; *— лекарственные средства, метаболизируемые CYP3A4.
Notes: CYP — cytochrome P-450; *— drugs metabolized by CYP3A4.
Клинически значимые взаимодействия ЛС и пищи происходят вследствие ингибирования активности ферментов, участвующих в I и II фазе метаболизма ЛС, а также белков-переносчиков, например, на фоне приёма фруктовых соков, фенольных и полифенольных соединений (например, р-крезол, выделенный из малины и ежевики; 3-этилфенол и 3,4-диметилфенол, отвечающие за дымный вкус некоторых какао-бобов; гидрохинон и др.) [16]. Так, Won CS и соавт. [16] показали, что одновременный приём соков цитрусовых и ЛС — субстратов CYP3A приводит к увеличению концентрации ЛС в плазме крови после их перорального (но не внутривенного) введения, что демонстрирует взаимодействие, опосредованное именно CYP3A, локализованном в кишечнике [16]. Изменение активности данных изоферментов может приводить к развитию НР, характерных для некоторых классов ЛС (например, миопатия при применении статинов) [6].
В таблице 2 суммированы данные о влиянии продуктов питания на активность изоферментов цитохрома Р-450 и иных значимых для метаболизма ЛС ферментов и белков-транспортёров [6–39].
Таблица 2
Примеры влияния некоторых продуктов питания на активность изоферментов цитохрома Р-450 и иных значимых для метаболизма ЛС ферментов и белков-транспортёров [6—39]
Table 2
Examples of the eff ect of some food products on the activity of cytochrome P-450 isoenzymes and other enzymes and transporter proteins that are important for the metabolism of drugs [6—39]
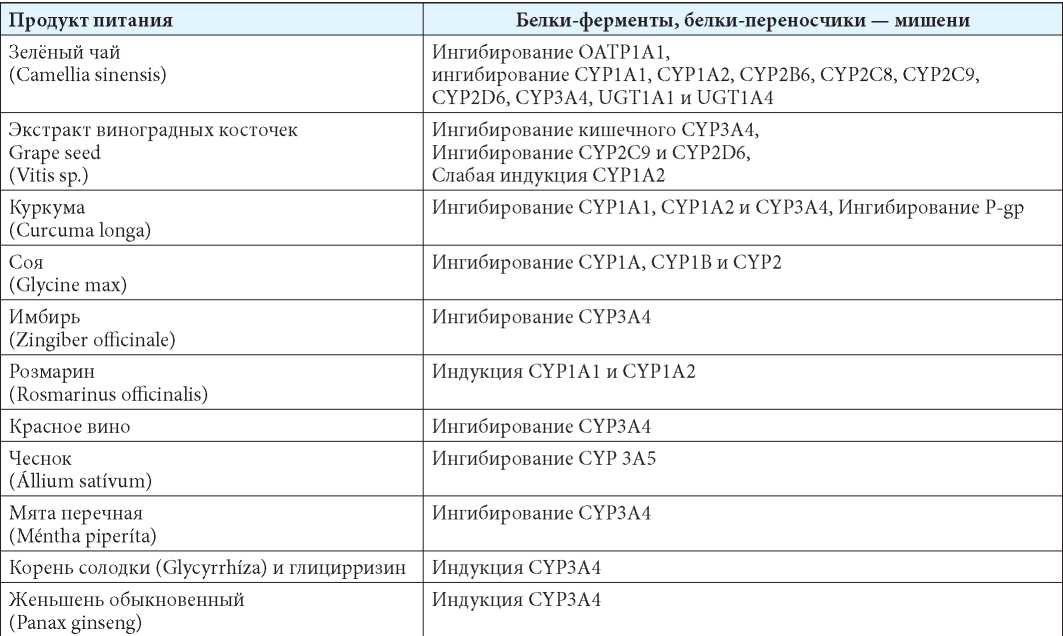
Примечания: CYP — цитохром Р450; Р-gp — Р-гликопротеин.
Notes: CYP — cytochrome P450; P-gp — P-glycoprotein.
Заключение / Conclusion
Таким образом, ЛС и продукты питания могут взаимодействовать друг с другом на фармакокинетическом уровне. Одновременный приём продуктов питания и ЛС может изменять степень абсорбции и метаболизм последних, что будет оказывать прямое влияние на профиль эффективности и безопасности фармакотерапии. Для обеспечения безопасности пациентов необходимо информировать врачей и пациентов о потенциальных рисках развития осложнений при одновременном приёме ЛС и пищи.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Благодарности. Работа выполнена без спонсорской поддержки.
Acknowledgements. The study was performed without external funding.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Conflict of interest. The authors declare no conflict of interest requiring disclosure in this article.
Участие авторов. Остроумова О. Д. — написание текста статьи, критический пересмотр содержания статьи, утверждение окончательного варианта статьи для публикации; Переверзев А. П. — сбор, анализ и систематизация данных научной литературы, написание текста статьи, оформление статьи, ответственность за все аспекты работы, связанные с достоверностью данных.
Participation of authors. Ostroumova OD — revision of the paper, approval of the final version of the paper for publication; Pereverzev AP — collection, analysis, and systematisation of literature data, writing and formatting of the paper, carrying responsibility for all aspects of the study related to data reliability
Список литературы
1. Сычёв Д. А., Остроумова О. Д., Кочетков А. И., Переверзев А. П., Остроумова Т. М., Клепикова М. В., Аляутдинова И. А., Эбзеева Е. Ю. Лекарственноиндуцированные заболевания: эпидемиология и актуальность проблемы. Фарматека. 2020;27(5):77–84. [Sychev DA, Ostroumova OD, Kochetkov AI, Pereverzev AP, Ostroumova TM, Klepikova MV, Alyautdinova IA, Ebzeeva EYu. Drug-induced diseases: epidemiology and urgency of the problem. Pharmateca. 2020;27(5):77–84. (In Russ).]
2. Hakkarainen KM, Gyllensten H, Jonsson AK, et al. Prevalence, nature and potential preventability of adverse drug events: a population-based medical record study of 4970 adults. Br J Clin Pharmacol. 2014;78(1):170–83. doi: 10.1111/bcp.12314.
3. Tisdale JE, Miller DA. Drug Induced Diseases: Prevention, Detection, and Management. 3rd Ed. Bethesda, Md.: American Society of HealthSystem Pharmacists; 2018; 1399 рр.
4. Сычев Д. А., Остроумова О. Д., Переверзев А. П., Кочетков А. И., Остроумова Т. М., Клепикова М. В., Эбзеева Е. Ю. Пожилой и старческий возраст пациентов как фактор риска развития лекарственно-индуцированных заболеваний. Безопасность и риск фармакотерапии. 2021;9(1):15– 24. [Sychev DA, Ostroumova OD, Pereverzev AP, Kochetkov AI, Ostroumova TM, Klepikova MV, Ebzeeva EYu. Advanced age as a risk factor of drug-induced diseases. Bezopasnost’ i risk farmakoterapii = Safety and Risk of Pharmacotherapy. 2021;9(1):15–24. (In Russ).]. doi: 10.30895/2312-7821-2021-9-1-15-24
5. Сычёв Д. А., Остроумова О. Д., Переверзев А. П., Кочетков А. И., Остроумова Т. М., Клепикова М. В., Эбзеева Е. Ю. Женский пол как фактор риска развития лекарственно-индуцированных заболеваний. Безопасность и риск фармакотерапии. 2021;9(2):85–94. [Sychev DA, Ostroumova OD, Pereverzev AP, Kochetkov AI, Ostroumova TM, Klepikova MV, Ebzeeva EYu. Female gender as a risk factor for drug-induced diseases. Bezopasnost’ i risk farmakoterapii = Safety and Risk of Pharmacotherapy. 2021;9(2):85–94. (In Russ).]. doi: 10.30895/2312-7821-2021-9-2-85-94
6. Koziolek M, Alcaro S, Augustijns P, Basit AW, Grimm M, Hens B, Hoad CL, Jedamzik P, Madla CM, Maliepaard M, Marciani L, Maruca A, Parrott N, Pávek P, Porter CJH, Reppas C, van Riet-Nales D, Rubbens J, Statelova M, Trevaskis NL, Valentová K, Vertzoni M, Čepo DV, Corsetti M. The mechanisms of pharmacokinetic food-drug interactions — A perspective from the UNGAP group. Eur J Pharm Sci. 2019 Jun 15;134:31–59. doi: 10.1016/j.ejps.2019.04.003
7. Kang SP, Ratain MJ. Inconsistent labeling of food effect for oral agents across therapeutic areas: differences between oncology and non-oncology products. Clin Cancer Res. 2010;16(17):4446–51. doi: 10.1158/1078-0432.ccr-10-0663
8. Willemsen AE, Lubberman FJ, Tol J, Gerritsen WR, van Herpen CM, van Erp NP. Effect of food and acid-reducing agents on the absorption of oral targeted therapies in solid tumors. Drug Discov Today. 2016 Jun;21(6):962– 76. doi: 10.1016/j.drudis.2016.03.002
9. Abdollahi M, Eslami S, Taherzadeh Z, Salehi S, Ebrahimi M. Factors Associated with Potential Food-Drug Interaction in Hospitalized Patients: A Cross-Sectional Study in Northeast Iran. Evidence Based Care. 2018;8(1):27–34. doi: 10.22038/EBCJ.2018.24726.1544
10. Carvalho REFLd, Reis AMM, Faria LMPd, Zago KSdA, Cassiani SHDB. Prevalence of drug interactions in intensive care units in Brazil. Acta Paulista de Enfermagem. 2013;26(2):150–7. doi: 10.1590/S0103-21002013000200008
11. Neves SJF, Marques A. Prevalence and predictors of potential drugfood interactions among the elderly using prescription drugs. Journal of Chemical and Pharmaceutical Research. 2016;8(4):965–2.
12. European Medicines Agency (EMA), 2012. Guideline on the Investigation of Drug Interactions. Committee for Human Medicinal Products (CHMP). Available from: https://www.ema.europa.eu/documents/scientific-guideline/guideline-investigation-drug-interactions_en.pdf (accessed 06.08.2021).
13. Food and drug Administration (FDA), 2002. Guidance for Industry: Food-Effect Bioavailability and Fed Bioequivalence Studies. Available from. https://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinfor mation/guidances/ ucm070241.pdf. (accessed 06.08.2021)
14. Koch KM, Reddy NJ, Cohen RB, et al. Effects of food on the relative bioavailability of lapatinib in cancer patients. J Clin Oncol. 2009;27(8):1191–6. doi: 10.1200/JCO.2008.18.3285.
15. Фармакология: учебник / под ред. Р. Н. Аляутдина. — 5-е изд., перераб. и доп. — М.: ГЭОТАР-Медиа, 2015. — 1104 с.: ил. [Pharmacology: textbook / ed. R.N. Alyautdina. — 5th ed., Rev. and add. Moscow: GEOTARMedia, 2015. (In Russ).].
16. Won CS, Oberlies NH, Paine MF. Mechanisms underlying food-drug interactions: inhibition of intestinal metabolism and transport. Pharmacol Ther. 2012 Nov;136(2):186–201. doi: 10.1016/j.pharmthera.2012.08.001
17. Hagenbuch B, Meier PJ. The superfamily of organic anion transporting polypeptides. Biochim Biophys Acta. 2003 Jan 10;1609(1):1–18. doi: 10.1016/s0005-2736(02)00633–8
18. Kobayashi D, Nozawa T, Imai K, Nezu J, Tsuji A, Tamai I. Involvement of human organic anion transporting polypeptide OATP-B (SLC21A9) in pH-dependent transport across intestinal apical membrane. J Pharmacol Exp Ther. 2003 Aug;306(2):703–8. doi: 10.1124/jpet.103.051300
19. Imanaga J, Kotegawa T, Imai H, Tsutsumi K, Yoshizato T, Ohyama T, Shirasaka Y, Tamai I, Tateishi T, Ohashi K. The effects of the SLCO2B1 c.1457C < T polymorphism and apple juice on the pharmacokinetics of fexofenadine and midazolam in humans. Pharmacogenet Genomics. 2011 Feb;21(2):84–93. doi: 10.1097/fpc.0b013e32834300cc
20. Tapaninen T, Neuvonen PJ, Niemi M. Grapefruit juice greatly reduces the plasma concentrations of the OATP2B1 and CYP3A4 substrate aliskiren. Clin Pharmacol Ther. 2010 Sep;88(3):339–42. doi: 10.1038/clpt.2010.101
21. Fuchikami H, Satoh H, Tsujimoto M, Ohdo S, Ohtani H, Sawada Y. Effects of herbal extracts on the function of human organic aniontransporting polypeptide OATP-B. Drug Metab Dispos. 2006 Apr;34(4):577– 82. doi: 10.1124/dmd.105.007872
22. Dresser GK, Bailey DG, Leake BF, Schwarz UI, Dawson PA, Freeman DJ, Kim RB. Fruit juices inhibit organic anion transporting polypeptidemediated drug uptake to decrease the oral availability of fexofenadine. Clin Pharmacol Ther. 2002 Jan;71(1):11–20. doi: 10.1067/mcp.2002.121152
23. Tsui JK, Ross S, Poulin K, Douglas J, Postnikoff D, Calne S, Woodward W, Calne DB. The effect of dietary protein on the efficacy of L-dopa: a double-blind study. Neurology. 1989 Apr;39(4):549–52. doi: 10.1212/wnl.39.4.549
24. Koven W, Schulte P. The effect of fasting and refeeding on mRNA expression of PepT1 and gastrointestinal hormones regulating digestion and food intake in zebrafish (Danio rerio). Fish Physiol Biochem. 2012 Dec;38(6):1565–75. doi: 10.1007/s10695-012-9649-6
25. Petric Z, Žuntar I, Putnik P, Bursać Kovačević D. Food-Drug Interactions with Fruit Juices. Foods. 2020;10(1):33. Published 2020 Dec 24. doi: 10.3390/foods10010033
26. Marchetti S, Mazzanti R, Beijnen JH, Schellens JH. Concise review: Clinical relevance of drug drug and herb drug interactions mediated by the ABC transporter ABCB1 (MDR1, P-glycoprotein). Oncologist. 2007 Aug;12(8):927–41. doi: 10.1634/theoncologist.12-8-927
27. Fenner KS, Troutman MD, Kempshall S, Cook JA, Ware JA, Smith DA, Lee CA. Drug-drug interactions mediated through P-glycoprotein: clinical relevance and in vitro-in vivo correlation using digoxin as a probe drug. Clin Pharmacol Ther. 2009 Feb;85(2):173–81. doi: 10.1038/clpt.2008.195
28. Keppler D. Multidrug Resistance Proteins (MRPs, ABCCs): Importance for Pathophysiology and Drug Therapy. Handb Exp Pharmacol. 2011;(201):299–323. doi: 10.1007/978-3-642-14541-4_8
29. van Zanden JJ, van der Woude H, Vaessen J, Usta M, Wortelboer HM, Cnubben NH, Rietjens IM. The effect of quercetin phase II metabolism on its MRP1 and MRP2 inhibiting potential. Biochemical Pharmacology. 2007 Jul;74(2):345–51. doi: 10.1016/j.bcp.2007.04.002
30. Chalet C, Rubbens J, Tack J, Duchateau GS, Augustijns P. Intestinal disposition of quercetin and its phase-II metabolites after oral administration in healthy volunteers. J Pharm Pharmacol. 2018 Aug;70(8):1002–8. doi: 10.1111/jphp.12929
31. Leslie EM, Deeley RG, Cole SP. Multidrug resistance proteins: role of P-glycoprotein, MRP1, MRP2, and BCRP (ABCG2) in tissue defense. Toxicol Appl Pharmacol. 2005 May 1;204(3):216–37. doi: 10.1016/j.taap.2004.10.012
32. Nakanishi T, Ross DD. Breast cancer resistance protein (BCRP/ ABCG2): its role in multidrug resistance and regulation of its gene expression. Chin J Cancer. 2012;31(2):73–99. doi: 10.5732/cjc.011.10320
33. Friedlander G, Le Grimellec C, Amiel C. Increase in membrane fluidity modulates sodium-coupled uptakes and cyclic AMP synthesis by renal proximal tubular cells in primary culture. Biochim Biophys Acta. 1990 Feb 16;1022(1):1–7. doi: 10.1016/0005-2736(90)90393-3
34. Arora A, Byrem TM, Nair MG, Strasburg GM. Modulation of liposomal membrane fluidity by flavonoids and isoflavonoids. Arch Biochem Biophys. 2000 Jan 1;373(1):102–9. doi: 10.1006/abbi.1999.1525
35. Paine MF, Hart HL, Ludington SS, Haining RL, Rettie AE, Zeldin DC. The human intestinal cytochrome P450 «pie». Drug Metab Dispos. 2006 May;34(5):880–6. doi: 10.1124/dmd.105.008672
36. Galetin A, Gertz M, Houston JB. Contribution of intestinal cytochrome p450-mediated metabolism to drug-drug inhibition and induction interactions. Drug Metab Pharmacokinet. 2010;25(1):28–47. doi: 10.2133/dmpk.25.28
37. Информационный портал для специалистов практического здравоохранения MSD manual: Лекарственные препараты, взаимодействующие с изоферментами цитохрома P450 (дата обращения: 06.08.2021) [Informational portal for healthcare practitioners MSD manual: Drugs interacting with cytochrome P450 isoenzymes. (Accessed: 06.08.2021) (In Russ).]. Available at: https://www.msdmanuals.com/ru-ru/профессиональный/multimedia/table/v1109123_ru.
38. Официальный сайт Агентства по контролю за пищевыми продуктами и лекарственными средствами США: таблица субстратов, индукторов и ингибиторов изоферментов цитохрома Р450 (дата обращения: 06.08.2021) [Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers (Accessed: 06.08.2021) (In Russ).]. Available at: https://www.fda.gov/drugs/drug-interactions-labeling/drug-developmentand-drug-interactions-table-substrates-inhibitors-and-inducers.
39. Bibi Z. Role of cytochrome P450 in drug interactions [retracted in: Nutr Metab (Lond). 2014 Feb 14;11(1):11. doi: 10.1186/1743-7075-11-11.]. Nutr Metab (Lond). 2008;5:27. Published 2008 Oct 18. doi: 10.1186/1743-7075-5-27
Об авторах
А. П. ПереверзевРоссия
Переверзев Антон Павлович, к. м. н., доцент кафедры терапии и полиморбидной патологии
SPIN-код: 4842-3770
Москва
О. Д. Остроумова
Россия
Остроумова Ольга Дмитриевна, д. м. н., профессор, зав. кафедрой терапии и полиморбидной патологии; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней
SPIN-код: 3910-6585
Москва
Рецензия
Для цитирования:
Переверзев А.П., Остроумова О.Д. Взаимодействие пищевых продуктов и лекарственных средств как фактор риска развития лекарственно индуцированных заболеваний: эпидемиология, факторы риска, потенциальные механизмы развития взаимодействий. Качественная клиническая практика. 2021;(3):31-38. https://doi.org/10.37489/2588-0519-2021-3-31-38
For citation:
Pereverzev A.P., Ostroumova O.D. Food-drug interaction as a risk factor of drug-induced diseases: epidemiology, risk factors, potential mechanisms of interaction. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):31-38. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-31-38














































